题目内容
设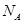 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A.1.7gH2O2中含有的中子数目为0.9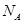 |
B.1molNa2O2固体中含离子总数为4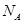 |
C.标准状况下,0.1molCl2溶于水,转移电子数目为0.1 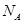 |
D.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1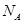 |
A
解析试题分析:A、1.7gH2O2中含有的中子数目=1.7÷34×16NA=0.9NA,正确;B、Na2O2含有钠离子和过氧根离子,1molNa2O2固体中含离子总数为3NA,错误;C、Cl2溶于水,不能完全反应,故转移的电子数少于0.1 NA,错误;D、没有溶液体积,仅能计算出离子的浓度,错误。
考点:考查阿伏伽德罗常数有关知识。

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是
| A.9 g D2O中含有的电子数为5 NA |
| B.46 g NO2和N2O4混合气体中含有原子数为3 NA |
| C.1 mol C2H6分子中共价键总数为8 NA |
| D.7.1 g C12与足量NaOH溶液反应转移的电子数为0.2 NA |
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是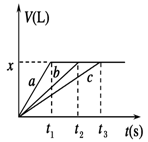
| A.x=2.24 |
| B.钠的物质的量为0.2 mol |
| C.反应时,Na、Mg、Al均过量 |
| D.曲线b为Mg与盐酸反应的图像 |
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
| A.OA段所发生反应的离子方程式: H++OH-=H2O;CO32-+H+=HCO3- |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1。 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
下列表述与化学用语正确的是
A.CO2的比例模型 |
B.氢化铵的电子式: 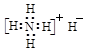 |
C.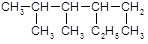 的名称:2,3-二甲基-4-乙基己烷 的名称:2,3-二甲基-4-乙基己烷 |
D.乙酸乙酯水解: |
下列溶液中c(Cl-)与50 mL 1 mol/LAlCl3溶液中c(Cl-)相等的是
| A.150 mL 1 mol/L的NaCl溶液 | B.75 mL 2 mol/L的NH4Cl溶液 |
| C.150 mL 2 mol/L的KCl溶液 | D.75 mL 1 mol/L的FeCl3溶液 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1molFe与过量的稀HNO3反应,转移2 NA个电子 |
| C.1mol/L NaCl溶液含有NA个Na+ |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2 NA个O原子 |
下列关于物质的量、摩尔质量的叙述中正确的是( )
| A.0.012 kg12C中含有约6.02×1023个碳原子 |
| B.1 mol H2O中含有2 mol氢和1 mol氧 |
| C.氢氧化钠的摩尔质量是40 g |
| D.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
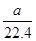 ×6.02×1023
×6.02×1023