题目内容
16.A、B、C、D为四种短周期元素,原子序数依次增大,原子半径按C、D、B、A的顺序逐渐减小.A、C位于同一主族,B、D位于同一主族;A、C的原子核内质子数之和为B、D的原子核内质子数之和的一半;C元素与其他三种元素均能形成离子化合物.试回答下列问题:
(1)B的离子符号为O2-;C、D形成的化合物的电子式为
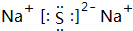 .
.(2)同时含有上述四种元素的化合物有多种,写出其中任意一种化合物的化学式NaHSO4等.
(3)由A、B、C中的两种元素组成的两种化合物相互反应生成A单质的化学方程式为NaH+H2O=NaOH+H2↑.
(4)由B、C、D中的两种元素组成的两种化合物发生的反应既属于化合反应又属于氧化还原反应,该反应的化学方程式为Na2O2+SO2=Na2SO4.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B、D位于同一主族,则B处于第二周期、D处于第三周期,A、C位于同一主族,原子半径按C、D、B、A的顺序逐渐减小,则A不能处于第二周期,只能处于第一周期,故A为H元素,则D为Na;A、C的原子核内质子数之和为B、D的原子核内质子数之和的一半,即B、D原子质子数之和为24,则B为O元素,D为S元素;Na元素与其它三种元素均能形成离子化合物,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B、D位于同一主族,则B处于第二周期、D处于第三周期,A、C位于同一主族,原子半径按C、D、B、A的顺序逐渐减小,则A不能处于第二周期,只能处于第一周期,故A为H元素,则D为Na;A、C的原子核内质子数之和为B、D的原子核内质子数之和的一半,即B、D原子质子数之和为24,则B为O元素,D为S元素;Na元素与其它三种元素均能形成离子化合物.
(1)B为O元素,离子符号为O2-,C、D形成的化合物为Na2S,电子式为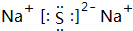 ,
,
故答案为:O2-;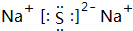 ;
;
(2)同时含有上述四种元素的化合物有多种,其中任意一种化合物的化学式为NaHSO4等,
故答案为:NaHSO4等;
(3)由H、O、Na中的两种元素组成的两种化合物相互反应生成氢气,应是NaH与水反应生成NaOH与氢气,反应的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
(4)由O、Na、S中的两种元素组成的两种化合物发生的反应既属于化合反应又属于氧化还原反应,是过氧化钠与二氧化硫反应生成硫酸钠,该反应的化学方程式为:Na2O2+SO2=Na2SO4,
故答案为:Na2O2+SO2=Na2SO4.
点评 本题考查结构性质位置关系应用、元素化合物性质等,推断元素是解题关键,(3)(4)为易错点、难点,中学基本不涉及,难度中等.

| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯在50℃~60℃时发生硝化反应,而甲苯在30℃时即可 |
| A. | 按系统命名法: 的名称为3,3,6三甲基4乙基庚烷 的名称为3,3,6三甲基4乙基庚烷 | |
| B. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸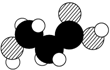 | |
| C. | 能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 | |
| D. | 木糖醇( 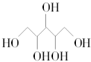 )和葡萄糖( )和葡萄糖(  )互为同系物,均属于糖类 )互为同系物,均属于糖类 |
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+$\frac{\underline{\;催化剂\;}}{\;}$H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的2Na2O2+2CO2═2Na2CO3+O2 |
| A. | R的最高价氧化物为RO3 | B. | R一定是第ⅦA族元素 | ||
| C. | R的气态氢化物能燃烧 | D. | R的气态氢化物易溶于水显碱性 |
 ,而不排布成
,而不排布成 ,其直接的根据是洪特规则.
,其直接的根据是洪特规则.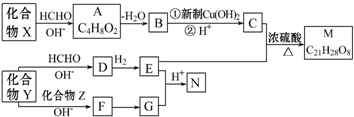
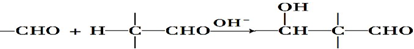
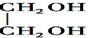 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$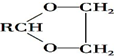 +H2O
+H2O
 .
.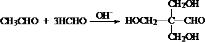 .
.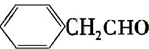
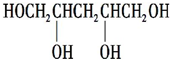 .
.