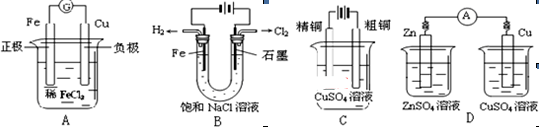
题目内容
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
| B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol |
C
解析

练习册系列答案
相关题目
关于原电池的叙述正确的是( )
| A.构成原电池的正极和负极必须是两种不同金属 |
| B.原电池是把化学能转变为电能的装置 |
| C.在铅、银和盐酸构成的原电池工作时,铅板上有5.18 g铅溶解,正极上就有1 120 mL(标准状况)气体析出 |
| D.原电池工作时,正极和负极上发生的都是氧化还原反应 |
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
A.在pH<4溶液中 ,碳钢主要发生析氢腐蚀
B.存pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O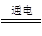 KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –-6e–+ 3H2O = IO3 – + 6H+ |
| C.在KI溶液溶液中加入酚酞,电解时阳极区变红色 |
| D.电解时溶液中I –向阴极迁移 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是
| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗6molH2O2转移电子6mol |
| C.电极a采用MnO2,MnO2既作电极又有催化作用 |
| D.该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+ |
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质。图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛。下列说法不正确的是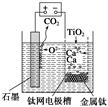
| A.阳极反应式为C + 2O2- - 4e-=CO2↑ |
| B.由TiO2制得1mol 金属Ti ,理论上外电路转移4 mol电子 |
| C.制备金属钛前后,装置中CaO的量不变 |
| D.TiO2在阴极放电 |
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(Na+)=0.2 mol·L-1 |
| B.电解后溶液中c(H+)=0.2 mol·L-1 |
| C.上述电解过程中共转移0.4 mol电子 |
| D.电解后得到的Cu的物质的量为0.1 mol |
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
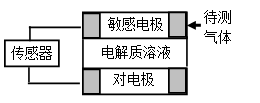
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同