题目内容
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
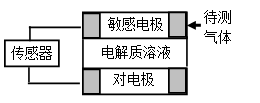
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
B
解析

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列有关原电池的说法中,正确的是( )
| A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )
| A.铜棒为正极,其电极反应式为:2H++2e-====H2↑ |
| B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C.反应中消耗锌的质量为13 g |
| D.导线中通过电子的物质的量为0.2 mol |
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-="=" Li+下列说法中正确的是
| A.充电时电池反应为FePO4+Li = LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电的正极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是
| A.产生气体的体积:(1)> (2) |
| B.电极上析出物质的质量:(1)> (2) |
| C.溶液pH的变化:(1)增大,(2)减小 |
| D.电极反应式:(1)中阳极:4OH--4e-===2H2O+O2↑,(2)中负极:2H++2e-===H2↑ |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是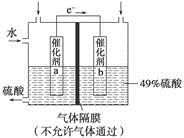
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
| B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol |
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |