题目内容
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
A.在pH<4溶液中 ,碳钢主要发生析氢腐蚀
B.存pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
C
解析试题分析:A、酸性条件下,碳钢发生析氢腐蚀,Fe-2e-= Fe2+,正确;B、当pH>6溶液中,碳钢主要发生吸氧腐蚀,负极电极反应式为:Fe-2e-=Fe2+,正极上电极反应式为:O2+2H2O+4e-=4OH-,正确;C.在pH>14溶液中,碳钢腐蚀的正极反应O2+2H2O+4e-=4OH-,错误;D.在煮沸除氧气后的碱性溶液中,正极上氧气生成氢氧根离子速率减小,所以碳钢腐蚀速率会减缓,正确,答案选C。
考点:考查金属的电化学腐蚀的种类与发生条件的判断

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
根据下图实验装置判断,下列说法正确的是
| A.该装置能将电能转化为化学能 |
| B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑ |
| C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3 |
下列关于实验现象的描述不正确的是 ( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是 ( )
| A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1 |
| B.在两个阳极上得到的产物的物质的量不相等 |
| C.硝酸亚汞的化学式为HgNO3 |
| D.硝酸亚汞的化学式为Hg2(NO3)2 |
下列有关四个电化学装置的叙述正确的是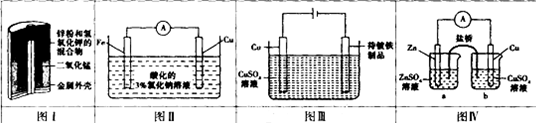
| A.图I装置中MnO2作催化剂 |
| B.图II装置工作一段时间后,滴加少量K3[Fe(CN)6]溶液,无明显现象 |
| C.图III装置中Cu作阳极,为电解液提供Cu2+,保持溶液中Cu2+浓度恒定 |
| D.图IV装置工作时,为平衡电荷,a烧杯中的Zn2+经盐桥移向b烧杯中 |
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )
| A.铜棒为正极,其电极反应式为:2H++2e-====H2↑ |
| B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C.反应中消耗锌的质量为13 g |
| D.导线中通过电子的物质的量为0.2 mol |
镍氢电池的总反应为 H2+2NiO(OH) 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
| A.NiO(OH) | B.Ni(OH)2 |
| C.H2 | D.H2和NiO(OH) |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
| B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑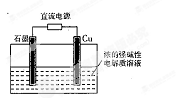
下列说法不正确的是
| A.石墨电极上产生氢气 |
| B.铜电极发生的电极反应为:2Cu -2e-+2OH-= Cu2O+H2O |
| C.铜电极接直流电源的正极 |
| D.当有0.1 mol电子转移时,有0.1 molCu2O生成 |