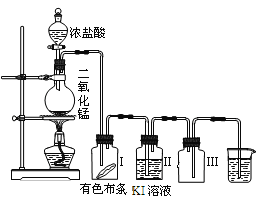
题目内容
【题目】五氧化二钒(V2O5)是接触法生产硫酸中常用的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
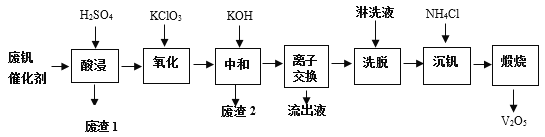
回答下列问题:
(1)提高“酸浸”效率的措施:________________;________________(写两条)。“废渣1”的主要成分是__________________________。
(2)“氧化”中主要是将VO2+变为VO2+,则氧化剂与还原剂之比为________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有__________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH + V4O124- ![]() R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式______。
【答案】升高温度 将废钒催化剂粉碎 SiO2 1:6 Fe(OH)3、Al(OH)3 碱 K+ 2NH4VO3![]() V2O5 + H2O↑ + 2NH3↑
V2O5 + H2O↑ + 2NH3↑
【解析】
从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH + V4O124- ![]() R4V4O12 + 4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此来解答。
R4V4O12 + 4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此来解答。
(1)提高酸浸常用方法为将将废钒催化剂粉碎或者提高温度等;废渣1主要是不溶于酸的二氧化硅,
故答案为:升高温度;将废钒催化剂粉碎;SiO2;
(2)氧化”中氧化剂为KClO3,Cl元素由+5降到-1价,降低6价,还原剂为VO2+,V元素由+4价升高到+5价,降低1价,根据电子守恒可知答案为:1:6;
(3)由上述流出分析可知滤渣2为Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)利用强碱性阴离子交换树脂可“离子交换”和“洗脱”,则应选择碱性条件下使用,且OH-浓度大反应逆向移动提高洗脱效率;由上述分析可知,流出液中主要为硫酸钾,则“流出液”中阳离子最多的是K+,
故答案为:碱;K+;
(5) “煅烧”中发生反应的化学方程式为2NH4VO3![]() V2O5 + H2O↑ + 2NH3↑,故答案为2NH4VO3
V2O5 + H2O↑ + 2NH3↑,故答案为2NH4VO3![]() V2O5 + H2O↑ + 2NH3↑;
V2O5 + H2O↑ + 2NH3↑;