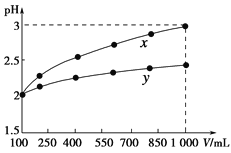
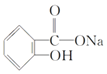
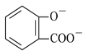
题目内容
【题目】某同学实验室用下列装置探究氯气的性质。
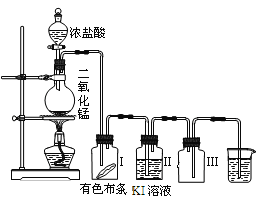
(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并判断电子得失数目__;__。
(2)实验时发现有色布条__,其原因是__;
(3)烧杯中溶液的作用是__;广口瓶Ⅲ的作用是__。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2e- 褪色 湿润的氯气可以使得有色布条褪色 吸收尾气,防止污染环境 收集气体
MnCl2+Cl2↑+2H2O 2e- 褪色 湿润的氯气可以使得有色布条褪色 吸收尾气,防止污染环境 收集气体
【解析】
(1)结合守恒法写出发生反应的化学方程式,由元素化合价的变化判断反应中转移的电子数目;
(2)氯气无漂白性,制备的氯气中含有水蒸气,氯气与水反应生成HClO;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ可收集气体。
(1)二氧化锰和浓盐酸反应得氯气,同时生成二氯化锰和水,则发生反应的化学方程式为MnO2+4HCl═MnCl2+Cl2+2H2O,在反应中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,;
(2)氯气无漂白性,制备的氯气中含有水蒸气,氯气与水反应生成的HClO有漂白性,则遇到有色布条会褪色;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ的作用是收集氯气。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】五氧化二钒(V2O5)是接触法生产硫酸中常用的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
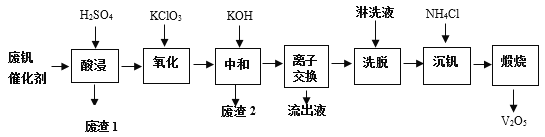
回答下列问题:
(1)提高“酸浸”效率的措施:________________;________________(写两条)。“废渣1”的主要成分是__________________________。
(2)“氧化”中主要是将VO2+变为VO2+,则氧化剂与还原剂之比为________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有__________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH + V4O124- ![]() R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式______。