题目内容
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
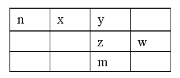
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
【答案】 2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol 2 < < 0.6mol/(L·min) 80% > 其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小
【解析】(1)①2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1 ,②O2(g)![]() O2(aq) △H =n kJ·mol-1,根据盖斯定律,将①+②得:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol,故答案为:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol;
O2(aq) △H =n kJ·mol-1,根据盖斯定律,将①+②得:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol,故答案为:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol;
(2)①当溶解氧浓度为4.0mgL-1时,c(Na2SO3)与速率数值关系如表,v1:v2=c1a(SO32-):c2a(SO32-), ![]() =
=![]() ,解得a=2;故答案为:2;
,解得a=2;故答案为:2;
②ln![]() =
=![]() (
(![]() -
-![]() )随着Ea的增大而增大,富氧区的ln
)随着Ea的增大而增大,富氧区的ln![]() 较小,故Ea(富氧区)<Ea(贫氧区);故答案为:<;
较小,故Ea(富氧区)<Ea(贫氧区);故答案为:<;
(3) 等物质的量的Na2SO3和Na2SO4混合溶液中,Na2SO3属于强碱弱酸盐,水解显碱性,根据物料守恒,c(SO32-)+c(HSO3-)+ c(H2SO3)= c(SO42-),则c(SO32-)+c(HSO3-)<c(SO42-),故答案为:<;
(4)①0到0.5min时:
5CO(g)+I2O5(s)5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)= ![]() =0.30,得x=0.6mol,则从反应开始至a点时的反应速率为v(CO)=
=0.30,得x=0.6mol,则从反应开始至a点时的反应速率为v(CO)=  =0.6molL-1min-1,故答案为:0.6molL-1min-1;
=0.6molL-1min-1,故答案为:0.6molL-1min-1;
② 5CO(g)+I2O5(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据a点时CO2的体积分数φ(CO2)= ![]() =0.80,得y=1.6mol,转化率等于=
=0.80,得y=1.6mol,转化率等于=![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
③其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小,则化学平衡常数:Kb>Kd,故答案为:>;其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小。

 发散思维新课堂系列答案
发散思维新课堂系列答案