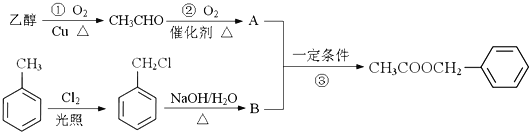
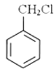
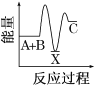
题目内容
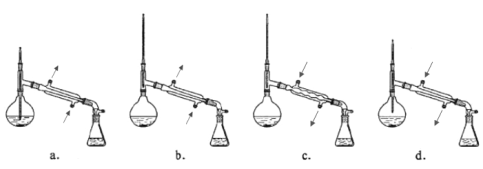
【题目】下列图中所示的实验方法、装置或操作正确的是( )
|
|
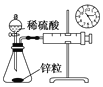
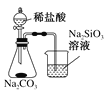
A.测量锌与稀硫酸反应的速率 | B.证明非金属性:Cl>C>Si |
|
|
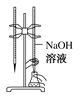
C.进行酸碱中和滴定实验 | D.测定中和热 |
A. A B. B C. C D. D
【答案】A
【解析】
A.通过测定一定时间内收集气体多少测量锌与稀硫酸反应速率;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
C.碱液只能盛放在碱式滴定管中;
D.中和热测定中需要用环形玻璃棒搅拌混合液。
A.通过测定一定时间内收集气体多少测量锌与稀硫酸反应速率,需要秒表、针筒等仪器,故A正确;
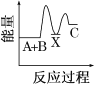
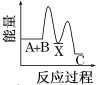
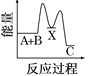
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,且盐酸具有挥发性,生成的二氧化碳中含有HCl,干扰碳酸与硅酸的酸性比较实验,该实验不能判断非金属性强弱,故B错误;
C.碱液只能盛放在碱式滴定管中,如果使用了酸式滴定管,NaOH能和玻璃中二氧化硅反应生成粘性物质硅酸钠导致活塞打不开,故C错误;
D.中和热测定中需要用环形玻璃棒搅拌,否则混合溶液温度不均匀,导致测定温度不准确,故D错误;
综上所述,本题选A。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。