题目内容
12.将9.75g锌加入到100ml 2mol/L 的盐酸中.当反应结束后求:(1)生成的ZnCl2的物质的量
(2)生成的氢气在标况下的体积.
分析 n(Zn)=$\frac{9.75g}{65g/mol}$=0.15mol,n(HCl)=2mol/L×0.1L=0.2mol,根据转移电子守恒知,如果锌完全溶解消耗n(HCl)=$\frac{0.15mol×2}{1}$=0.3mol>0.2mol,说明锌有剩余;
(1)稀盐酸完全反应,根据Cl原子守恒计算ZnCl2的物质的量;
(2)根据H原子守恒计算生成氢气在标况下体积.
解答 解:n(Zn)=$\frac{9.75g}{65g/mol}$=0.15mol,n(HCl)=2mol/L×0.1L=0.2mol,根据转移电子守恒知,如果锌完全溶解消耗n(HCl)=$\frac{0.15mol×2}{1}$=0.3mol>0.2mol,说明锌有剩余;
(1)稀盐酸完全反应,根据Cl原子守恒得n(ZnCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.2mol=0.1mol,答:生成的ZnCl2的物质的量为0.1mol;
(2)根据H原子守恒得生成标况下V(H2)=$\frac{1}{2}$n(HCl)Vm=$\frac{1}{2}$×0.2mol×22.4L/mol=2.24L,答:生成氢气在标况下体积是2.24L.
点评 本题考查化学反应方程式的有关计算,为高频考点,侧重考查学生分析计算能力,注意该题要先进行过量计算,为易错点,注意原子守恒的灵活运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度均为2mol/L,取10mL此混合酸,向其中加入过量的铜粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO).( )
| A. | 0.224L | B. | 0.336L | C. | 0.448L | D. | 0.672L |
20.下列实验目的能够实现的是( )
| A. | 用托盘天平称取3.23 g NaCl固体 | B. | 用50 mL量筒量取30.12 mL水 | ||
| C. | 向小试管中加入100 mL稀盐酸 | D. | 用胶头滴管取约1 mL溶液 |
4.用NA表示阿伏加德罗常数,下列叙述中,正确的是( )
| A. | 常温常压下,11.2L氦气所含的原子数为NA | |
| B. | 常温常压下,钠与水反应生成1g氢气转移电子数为NA | |
| C. | 1L 1mol•L-1的CH3COOH溶液中含H+离子数为NA | |
| D. | 1.9g的H3O+离子中含有的电子数为1.1NA |
15.下列描述中正确的是( )
| A. | 强酸与强碱反应都是放热反应 | |
| B. | 氧化还原反应一定都是放热反应 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
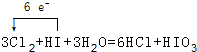 .
.