题目内容
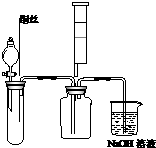
9.氮化硅的强度很高,尤其是热压氮化硅,是世界上最坚硬的物质之一,氮化硅陶瓷可做燃气轮机的燃烧室、机械密封环、输送铝液的电磁泵的管道及阀门、永久性模具、钢水分离环等.制备氮化硅可将硅粉放在氮气中加热至1000℃左右直接氮化制得,实验室制备氮化硅装置示意图如下:
回答下列问题:
(1)a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如右图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
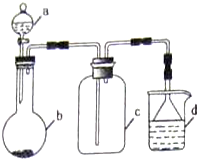
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
分析 (1)a为分液漏斗;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平书写方程式;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置B除去氧气(及氮氧化物)、C干燥氮气;
(4)氮化硅溶于氢氟酸溶液生成一种白色的胶状沉淀为硅酸,根据元素守恒确定另一种产物;
(5)A.氨气密度比空气小;
B.澄清石灰水浓度较小;
C.铁与稀硝酸反应产生的气体为NO,一氧化氮难溶于水;
D.浓盐酸和高锰酸钾反应生成氯气.
解答 解:(1)由图中仪器结构可知,a为分液漏斗,故答案为:分液漏斗;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平后方程式为:2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O,故答案为:2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置B除去氧气(及氮氧化物)、C干燥氮气,防止对D装置反应的影响,故答案为:除去氧气(及氮氧化物);除去水蒸气;
(4)氮化硅溶于氢氟酸溶液生成一种白色的胶状沉淀为硅酸,元素守恒确定另一种产物为NH4F,则反应的方程式为:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
故答案为:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)A.氨气密度比空气小,集气瓶中导管应短进长出,故A错误;
B.澄清石灰水浓度较小,不能用来处理尾气,故B错误;
C.铁与稀硝酸反应产生的气体为NO,一氧化氮难溶于水,不能用溶液吸收,故C错误;
D.浓盐酸和高锰酸钾反应生成氯气,氯气可用氢氧化钠吸收,故D正确;
故选D.
点评 本题考查了制备方案设计,题目难度中等,侧重于考查学生的实验探究能力,注意把握硅及其化合物的性质,明确实验目的和实验原理是解题的关键.

| A. | 15.6% | B. | 25% | C. | 30% | D. | 无法确定 |
| A. | 熔点:Li>Cs>Na | B. | 微粒半径:Ca2+>C1->Mg2+ | ||
| C. | 碱性:KOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:Cu2+>Fe3+>K+ |
 (1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.
(1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.