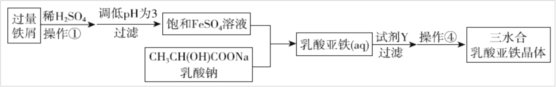
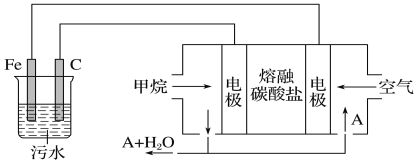
题目内容
【题目】化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化 1 L 污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用 1.176 g K2Cr2O7固体配制成 100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,消耗Fe(NH4)2(SO4)2溶液的体积如下表所示。此时,发生的反应是CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(已知K2Cr2O7和有机物反应时被还原为 Cr3+,K2Cr2O7的相对分子质量为294)
序号 | 起始读数/mL | 终点读数/mL |
1 | 0.00 | 12.10 |
2 | 1.26 | 13.16 |
3 | 1.54 | 14.64 |
(1)K2Cr2O7溶液的物质的量浓度为______mol·L-1。
(2)求该湖水的COD为______mg·L-1。
【答案】0.0400 480
【解析】
(1)根据n=![]() 及c=
及c=![]() 计算K2Cr2O7溶液的物质的量浓度;
计算K2Cr2O7溶液的物质的量浓度;
(2)根据CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,计算剩余的K2Cr2O7的物质的量,进而计算水样消耗的n(K2Cr2O7);再根据电子转移守恒计算水样消耗氧气的物质的量,及计算水样的化学需氧量,据此解答。
(1)K2Cr2O7的摩尔质量为294 g/mol,则1.176 g K2Cr2O7固体的物质的量是n(K2Cr2O7)=![]() =0.0040 mol,由于配制成100 mL溶液,所以配制K2Cr2O7的溶液的物质的量浓度c(K2Cr2O7)=
=0.0040 mol,由于配制成100 mL溶液,所以配制K2Cr2O7的溶液的物质的量浓度c(K2Cr2O7)=![]() =0.0400 mol/L;
=0.0400 mol/L;
(2)n(K2Cr2O7)=0.01 L×0.0400 mol/L=4×10-4 mol,三次实验消耗溶液的体积分别是12.10 mL、11.90mL、13.10 mL,可见第三次实验误差较大,要舍去,则消耗溶液平均体积是V=![]() =12.00 mL、n(Fe2+)=12×10-3 L×0.10 mol/L=1.2×10-3 mol,由CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,剩余的n(K2Cr2O7)=
=12.00 mL、n(Fe2+)=12×10-3 L×0.10 mol/L=1.2×10-3 mol,由CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,剩余的n(K2Cr2O7)=![]() n(Fe2+)=
n(Fe2+)=![]() ×1.2×10-3 mol=2×10-4 mol,则水样消耗的n(K2Cr2O7)=4×10-4 mol-2×10-4 mol=2×10-4 mol,根据电子电子转移可知,水样需要氧气的物质的量为n(O2)=
×1.2×10-3 mol=2×10-4 mol,则水样消耗的n(K2Cr2O7)=4×10-4 mol-2×10-4 mol=2×10-4 mol,根据电子电子转移可知,水样需要氧气的物质的量为n(O2)=![]() ×[2×10-4mol×(6-3)×2]=3×10-4 mol,氧气的质量m(O2)=3×10-4 mol×32 g/mol=96×10-4 g=9.6 mg,故该水样的化学需氧量COD=
×[2×10-4mol×(6-3)×2]=3×10-4 mol,氧气的质量m(O2)=3×10-4 mol×32 g/mol=96×10-4 g=9.6 mg,故该水样的化学需氧量COD=![]() =480 mg/L。
=480 mg/L。