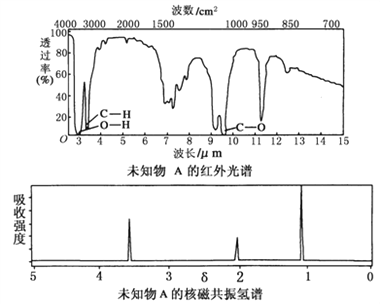
��Ŀ����
����Ŀ�����ʺͻ������ڹ�ũҵ������������Ҫ��Ӧ�ã���SO2ֱ���ŷŻ�Ի������Σ����
��.SO2��β������ͨ�������¼��ַ�����
��1������̿��ԭ�� ��Ӧԭ�������º���ʱ2C(s)+2SO2(g)![]() S2(g)+2CO2(g)����Ӧ���е���ͬʱ���ø����ʵ�Ũ�Ȳ���ͼ����ͼ��
S2(g)+2CO2(g)����Ӧ���е���ͬʱ���ø����ʵ�Ũ�Ȳ���ͼ����ͼ��
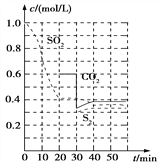
��0��20 min��Ӧ���ʱ�ʾΪv(SO2)=________��
��30 minʱ���ı�ijһ����ƽ�ⷢ���ƶ�����ı���������п�����________��
��40 minʱ��ƽ�ⳣ��K=________��
��2�������������շ� ��Na2SO3��Һ����SO2�����ӷ���ʽΪ__________________��
�ڳ����£���������NaHSO3ʱ������Һ���������Ũ�ȹ�ϵһ����ȷ����___(�����)��
a��c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
b��ˮ�����c(H+)=1��108 mol/L
c��c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )
)
��3���绯ѧ������
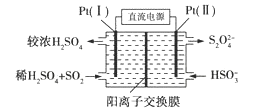
����ͼ��ʾ��Pt(��)�缫�ķ�ӦʽΪ__________________��
�ڵ���·��ת��0.02 mol eʱ(��ŨH2SO4��δ�ų�)������Ĥ�����Һ��Լ����____mol���ӡ�
���𰸡� 0.03 mol/(L��min) ����CO2��Ũ�� 0.675 ![]() +SO2+H2O
+SO2+H2O![]() 2
2![]() ac SO22e+2H2O
ac SO22e+2H2O![]()
![]() +4H+ 0.03
+4H+ 0.03
����������1������ͼ��֪��0��20 min�ڶ�������Ũ�ȱ仯��Ϊ1-0.4=0.6mol/L���ʶ�������ķ�Ӧ����=![]() =0.03 mol/(L��min)����30 minʱ˲�䣬������̼��Ũ�Ƚ��ͣ�S2��Ũ�Ȳ��䣬���������̼��S2��Ũ�Ⱦ�����Ӧ�Ǽ���CO2��Ũ������40 minʱ��ƽ�ⳣ��K=
=0.03 mol/(L��min)����30 minʱ˲�䣬������̼��Ũ�Ƚ��ͣ�S2��Ũ�Ȳ��䣬���������̼��S2��Ũ�Ⱦ�����Ӧ�Ǽ���CO2��Ũ������40 minʱ��ƽ�ⳣ��K=![]() =
=![]() =0.675����2����2����Na2SO3��Һ��SO2��Ӧ�������������ƣ���Ӧ���ӷ���ʽΪ��SO32-+SO2+H2O=2HSO3-����a�����ݵ���غ㣺c��Na+��+c��H+��=2c��SO32-��+c��HSO3-��+c��OH-��������Һ��c��Na+��+c��H+��>c��SO32-��+c��HSO3-��+c��OH-������a��ȷ��b��NaHSO3��Һ��������������ӵ����ˮ�⣬ˮ�����c(H+)
=0.675����2����2����Na2SO3��Һ��SO2��Ӧ�������������ƣ���Ӧ���ӷ���ʽΪ��SO32-+SO2+H2O=2HSO3-����a�����ݵ���غ㣺c��Na+��+c��H+��=2c��SO32-��+c��HSO3-��+c��OH-��������Һ��c��Na+��+c��H+��>c��SO32-��+c��HSO3-��+c��OH-������a��ȷ��b��NaHSO3��Һ��������������ӵ����ˮ�⣬ˮ�����c(H+)![]() 1��108 mol/L����b������c��NaHSO3��Һ��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����Һ��c��Na+��>c��HSO3-��>c��H+��>c��SO32-������c��ȷ����ѡac����3������ͼ��֪��Pt��1���缫�϶������������������ᣬ�缫��ӦʽΪ��SO22e+2H2O
1��108 mol/L����b������c��NaHSO3��Һ��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����Һ��c��Na+��>c��HSO3-��>c��H+��>c��SO32-������c��ȷ����ѡac����3������ͼ��֪��Pt��1���缫�϶������������������ᣬ�缫��ӦʽΪ��SO22e+2H2O![]()
![]() +4H+�������缫��ӦʽΪ��SO22e+2H2O
+4H+�������缫��ӦʽΪ��SO22e+2H2O![]()
![]() +4H+�����ݵ���ת���غ㣬������������ʵ���
+4H+�����ݵ���ת���غ㣬������������ʵ���![]() =0.01mol������������Ϊ0.04mol��Ϊ������Һ�����ԣ�0.01mol�������Ҫ0.02mol�����ӣ������������ͨ�������ӽ���Ĥ�����Ҳ࣬����0.02mol�����������Ҳ࣬�������Һ����������Ϊ0.01mol+0.02mol=0.03mol��
=0.01mol������������Ϊ0.04mol��Ϊ������Һ�����ԣ�0.01mol�������Ҫ0.02mol�����ӣ������������ͨ�������ӽ���Ĥ�����Ҳ࣬����0.02mol�����������Ҳ࣬�������Һ����������Ϊ0.01mol+0.02mol=0.03mol��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�