题目内容
【题目】铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:

回答下列问题:
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为________,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。

(3)“置换”时生成单质铋的离子方程式为________。“母液1”中通入气体X后可循环利用,气体X的化学式为________。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极________;阴极________。
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。
【答案】 ![]() 6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S Bi3++H2O+Cl-=BiOCl+2H+ 2Bi3++3Fe=3Fe2++2Bi Cl2 Pb-2e-=Pb2+ Pb2++2e-=Pb 没有污染性气体产生 NH4NO3
6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S Bi3++H2O+Cl-=BiOCl+2H+ 2Bi3++3Fe=3Fe2++2Bi Cl2 Pb-2e-=Pb2+ Pb2++2e-=Pb 没有污染性气体产生 NH4NO3
【解析】(1)Bi位于元素周期表第六周期,与N、P同族,Bi原子核内有83个质子,Bi的原子结构示意图为:![]() 。
。
(2)由流程中从浸出渣中回收S,所以“浸出”时Bi2S3与FeCl3溶液反应生成S单质,+3价铁被还原为+2价铁,化学方程式为:6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S;Bi3+水解会生成难溶物BiOCl(碱式氯化铋),方程式为:Bi3++H2O+Cl-=BiOCl+2H+,反应液必须保持强酸性,抑制水解,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低。
(3)铋元素在浸出液中以Bi3+形式存在,所以加入Fe“置换”时生成单质铋的离子方程式为:2Bi3++3Fe=3Fe2++2Bi;“母液1”中含有Fe2+和Cl-,通入Cl2后生成FeCl3可循环利用。
(4)根据电解原理:阳极发生氧化反应,阴极发生还原反应,因为电解后,阳极底部留下的为精铋,所以阳极反应为:Pb-2e-=Pb2+,由图知溶液中Pb2+在阴极放电,反应式为:Pb2++2e-=Pb。
(5)直接灼烧碱式硝酸铋也能得到Bi2O3,但还会产生污染性的氮氧化物气体,所以上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是:没有污染性气体产生;(NH4)2CO3溶液与碱式硝酸铋反应,生成碱式碳酸铋和硝酸铵,故“母液2”中可回收的主要物质是NH4NO3。

【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | 基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
请根据表中信息填写:
⑴A元素在元素周期表中的位置____________________________________________。
⑵离子半径:B_________A(填“大于”或“小于”)。
⑶C原子的电子排布图是______________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
⑷B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的离子方程式为_____________,与D最高价氧化物的水化物水溶液反应的化学方程式为___________。
⑸E元素基态原子的电子排布式为____________________.
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

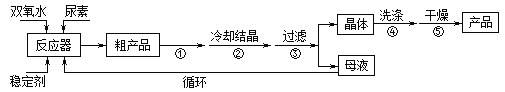
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
