题目内容
17.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | D. | 元素的金属性:A>B>D>C |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,A、B为金属,C、D为非金属,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,A、B为金属,C、D为非金属.
A.A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:r(B)>r(A)>r(D)>r(C),故A错误;
B.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,所以原子序数:a>b>d>c,故B错误;
C.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径:r(C3-)>r(D-)>r(B+)>r(A2+),故C正确;
D.同周期自左而右,金属性减弱,A、B为金属,A、B同周期,a>b,所以金属性B>A;C、D同周期,为非金属,原子序数d>c,非金属性D>C,故金属性为B>A>C>D,故D错误;
故选:C.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,也可以确定具体元素进行解答,难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
10.下列说法正确的是( )
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
8.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
| A. | WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型相同 | |
| C. | 原子半径大小顺序为X<W<Y<Z | |
| D. | 非金属性Y<Z |
5.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A. | 氯化铝 | B. | 石蕊 | C. | 亚硫酸钠 | D. | 硝酸银 |
12.下列物质的分离方法不正确的是( )
| A. | 用结晶的方法分离汽油和水 | |
| B. | 用过滤的方法除去氯化钠溶液中的泥沙 | |
| C. | 用重结晶的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | |
| D. | 蒸馏法分离乙酸(沸点118.)和乙酸乙酯(沸点77.1.) |
2.普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
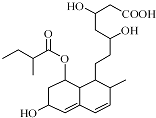

| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 不能发生加成、取代、消去反应 | |
| D. | 1mol 该物质最多可与3mol NaOH 反应 |
9.在一定的温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C分解速率与B生成速率相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmol A,同时生成3nmol B | |
| D. | A、B、C的分子数之比为1:3:2 |
7.根据电子排布的特点,Ar在周期表属于( )
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |