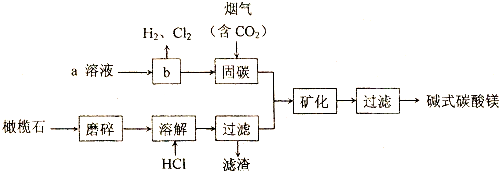
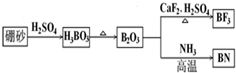
题目内容
5.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )| A. | 氯化铝 | B. | 石蕊 | C. | 亚硫酸钠 | D. | 硝酸银 |
分析 氯水中含有的微粒有:Cl2、H2O、HClO、H+、OH-、Cl-、ClO-,次氯酸有漂白性和强氧化性,氯气有强氧化性,该溶液呈酸性,所以该溶液能和碱反应、能和还原性的物质反应、和银离子生成白色沉淀.
解答 解:A.氯化铝和氯水中各成分都不反应,所以用自来水配制氯化铝溶液不变质,故A选;
B.石蕊试液是酸碱指示剂,次氯酸能漂白石蕊试液,所以不能用自来水配制石蕊,故B不选;
C.亚硫酸钠具有还原性,能被次氯酸、氯气氧化而变质,故C不选;
D.硝酸银和氯离子反应生成AgCl白色沉淀而变质,故D不选;
故选A.
点评 本题考查氯水性质,明确氯水中成分及其性质是解本题关键,氯水具有漂白性、酸性、强氧化性,题目难度不大.

练习册系列答案
相关题目
19.下列反应中,既属于离子反应,又属于有颜色变化的氧化还原反应的是( )
| A. | FeCl3溶液和KSCN溶液混合 | B. | 锌放入稀硫酸中 | ||
| C. | 铜片放入氯化铁溶液中 | D. | 硫酸铜溶液与氢氧化钠溶液混合 |
20.下列递变规律正确的是( )
| A. | 热稳定性:HCl>HF>H2O | B. | 沸点:金刚石>冰>干冰 | ||
| C. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 | D. | 元素的最高正化合价:F>S>C |
10.下列各原子或离子的电子排布式错误的是( )
| A. | Ca2+ 1s22s22p63s23p6 | B. | O2-1s22s23p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar 1s22s22p63s23p6 |
17.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | D. | 元素的金属性:A>B>D>C |
14.下列有机物的命名正确的是( )
| A. | 1,2-二甲基戊烷 | B. | 2-乙基-3-戊烯 | ||
| C. | 3,4-二甲基-4-丁醇 | D. | 3-甲基-2-戊醇 |
15.家庭居室装潢后,室内产生污染的有机气体是( )
| A. | SO2 | B. | CO | C. | HCHO | D. | NO |