题目内容
【题目】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。
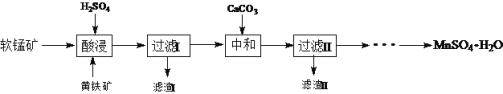
(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____。酸浸时,硫酸过量的目的是:①____;②____。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____。CaCO3用量过大,对MnSO4·H2O产量的影响是,____(填“升高”“降低”或“无影响”)。
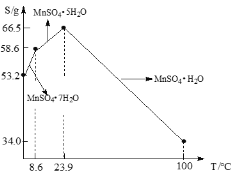
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____,使固体MnSO4·H2O与溶液分离,____、真空干燥。
【答案】Fe、S(或铁、硫) 提高锰元素的浸出率 抑制Mn2+水解 Fe2(SO4)3++3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑ 降低 趁热过滤 用80℃~90℃的蒸馏水洗涤2~3次
【解析】
根据流程中发生的化学反应,应用混合物分离提纯的方法,逐步分析回答问题。
(1)酸浸主要反应中,锰从+4降至+2价,被还原;铁从+2升至+3价、硫从-1升至+6价,被氧化。使用过量的硫酸,可使软锰矿充分反应,提高锰元素的浸出率;多余的硫酸可抑制Mn2+、Fe3+水解,防止Mn2+生成沉淀而损失。
(2)过滤I所得滤液中Fe3+水解Fe3++3H2O![]() Fe(OH)3+3H+,中和时加入的CaCO3与H+反应CaCO3+2H+=Ca2++CO2↑+H2O,水解平衡右移Fe3+转化为Fe(OH)3沉淀,总反应的化学方程式为Fe2(SO4)3+3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑。若CaCO3用量过大,部分Mn2+水解转化成Mn(OH)2沉淀混入滤渣II,使MnSO4·H2O产量降低。
Fe(OH)3+3H+,中和时加入的CaCO3与H+反应CaCO3+2H+=Ca2++CO2↑+H2O,水解平衡右移Fe3+转化为Fe(OH)3沉淀,总反应的化学方程式为Fe2(SO4)3+3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑。若CaCO3用量过大,部分Mn2+水解转化成Mn(OH)2沉淀混入滤渣II,使MnSO4·H2O产量降低。
(3)据溶解度曲线图,要从过滤Ⅱ所得MnSO4溶液中获得较高纯度的MnSO4·H2O晶体,应在80 ℃~90 ℃之间进行蒸发结晶、趁热过滤,再用80℃~90℃的蒸馏水洗涤MnSO4·H2O晶体2~3次,最后真空干燥。