题目内容
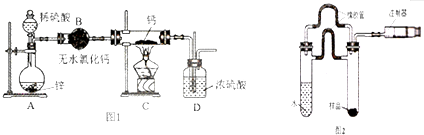
12.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是分液漏斗
(2)实验过程中,装置B、C中发生的现象分别是溶液由紫红色变为无色、出现黄色浑浊,这些现象分别说明SO2具有的性质是还原性和氧化性;装置B中发生反应的离子方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+
(3)下列药品中能够用来证明反应结束后的烧瓶中的确有余酸的是:AD(填写字母编号,有几个写几个,多写或写错0分).
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(4)装置D的目的是探究SO2与品红作用的可逆性,当品红褪色后在点燃酒精灯前应必须注意待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色.
(5)尾气可采用NaOH溶液吸收.
分析 (1)根据化学常用仪器的形状及仪器的名称来分析;
(2)利用二氧化硫与高锰酸钾溶液,二氧化硫与硫化钠的氧化还原反应来分析反应现象和性质,依据离子性质和电荷守恒,原子守恒配平书写离子方程式;
(3)根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子,从能够与氢离子反应并且有明显现象的来分析;
(4)根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色来解答;
(5)利用二氧化硫的性质来分析尾气处理,利用发生的化学反应来书写吸收尾气的离子反应.
解答 解:(1)装置A中盛放浓硫酸的仪器名称是分液漏斗,故答案为:分液漏斗;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊,体现二氧化硫的氧化性,高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,
故答案为:溶液由紫红色变为无色;出现黄色浑浊;还原性;氧化性;2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
(3)根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子,
A.铁粉与氢离子反应产生气泡,故A正确;
B.BaCl2溶液只能与硫酸根产生沉淀,故B错误;
C.银粉不反应,无现象,故C错误;
D.Na2CO3溶液与氢离子反应产生气泡,故D正确;
故选:AD;
(4)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(5)利用氢氧化钠溶液来吸收尾气,发生的离子反应为SO2+2OH-=SO32-+H2O,故答案为:NaOH.
点评 本题考查了二氧化硫的制取及二氧化硫的性质实验,题目难度中等,明确反应原理、二氧化硫的性质是解答本题的关键,注意掌握二氧化硫的性质及性质实验方案设计方法.

①KNO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ②③④ | D. | 全部 |
| A. | 200mL O2 | B. | 150ml H2 | ||
| C. | 100mL H2和100mL F2 | D. | 150mL NH3和150mL HCl |
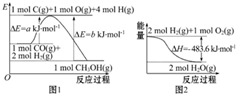
| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| C. | 1 mol NaOH分别和1 mol 稀硫酸、1 mol浓硫酸反应,前者的△H比后者的△H大 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
| A. | baXn-中含有的中子数为a+b | B. | baXn-中含有的电子数为a-n | ||
| C. | X原子的质量约为(b/NA)g | D. | 此元素的相对原子质量为b |