题目内容
5.12.8g氧气与标准状况下的8.96L CO2气体所含氧原子数相同,与17.92L CO气体含有的氧原子数相等,与0.4mol SO2所含分子数相同.分析 根据n=$\frac{m}{M}$计算氧气物质的量,氧气、二氧化碳分子都含有2个氧原子,每个CO分子含有1个氧原子,氧气与二氧化碳含有分子数目相等,则二者物质的量相等,氧气与CO含有氧原子数目相等,则CO物质的量为氧气的2倍,再根据V=nVm计算二氧化碳、CO的体积;氧气与二氧化硫分子数相等,则二者物质的量相等.
解答 解:12.8g 氧气的物质的量为$\frac{12.8g}{32g/mol}$=0.4mol,
氧气、二氧化碳分子都含有2个氧原子,每个CO分子含有1个氧原子,氧气与二氧化碳含有分子数目相等,则二者物质的量相等,故二氧化碳的体积为0.4mol×22.4L/mol=8.96L,氧气与CO含有氧原子数目相等,则CO物质的量为氧气的2倍,CO的体积为:0.4mol×2×22.4L/mol=17.92L,
氧气与二氧化硫分子数相等,则二者物质的量相等,即二氧化硫为0.4mol,
故答案为:8.96;17.92;0.4.
点评 本题考查物质的量有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
15.下列实验现象描述正确的是( )
| A. | 钠在氧气中燃烧火焰呈白色,生成淡黄色固体 | |
| B. | 铁与稀硫酸反应,产生大量的气体,生成棕黄色溶液 | |
| C. | 铜与氯气反应产生棕黄色的烟,加少量水后溶液呈蓝绿色 | |
| D. | 氢气在氯气中燃烧产生苍白色烟雾,生成有刺激性气味的气体 |
16.微波炉加热时,电炉内的微波场以极高的频率改变电场的方向,使水分子迅速摆动而产生热效应.在高频改变方向的电场中水分子会迅速摆动的原因是( )
| A. | 水分子具有极性共价键 | B. | 水分子中有共用电子对 | ||
| C. | 水由氢、氧两种元素的原子组成 | D. | 水分子是极性分子 |
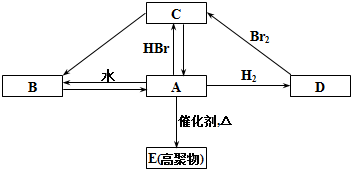
20.下列烷烃的诸多同分异构体中,某种同分异构体的一氯代物可以只有一种,这种烷烃是( )
| A. | 正二十一烷 | B. | 正二十五烷 | C. | 正二十六烷 | D. | 正二十七烷 |
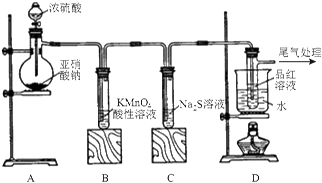
9.用下列装置进行相应实验,能达到实验目的是( )
| A. |  配制一定浓度的稀硫酸 | B. | 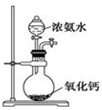 实验室制取氨气 | ||
| C. |  蒸发饱和食盐水 | D. |  制取、收集氢气 |