题目内容
【题目】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( ) 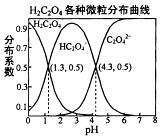
A.HC2O4﹣H++C2O42﹣ , K=1×10﹣4.3
B.将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3
C.常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣
D.在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)
【答案】B
【解析】解:A.由HC2O4﹣H++C2O42﹣ , 可知K= ![]() ,pH=4.3时,c(C2O42﹣)=c(HC2O4﹣),所以K=
,pH=4.3时,c(C2O42﹣)=c(HC2O4﹣),所以K= ![]() =c(H+)=1×10﹣4.3 , 故A正确;B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,HC2O4﹣电离程度大于C2O42﹣的水解程度,所以溶液中c(C2O42﹣)>c(HC2O4﹣),则溶液PH大于4.3,故B错误;
=c(H+)=1×10﹣4.3 , 故A正确;B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,HC2O4﹣电离程度大于C2O42﹣的水解程度,所以溶液中c(C2O42﹣)>c(HC2O4﹣),则溶液PH大于4.3,故B错误;
C.常温下H2C2O4的K1=10﹣1.3 , K2=10﹣4.3 , HF的KB=1×10﹣3.45 , 则酸性:H2C2O4>HF>HC2O4﹣ , 所以将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为H2C2O4+F﹣=HF+HC2O4﹣;故C正确;
D.NaHC2O4溶液显酸性,以HC2O4﹣的电离为主,在溶液中部分电离HC2O4﹣ , 则各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣),故D正确.
故选B.

【题目】碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图: 
已知:碳酸锂的溶解度为((g/L)
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为
(2)硫酸化焙烧温度控制在250℃﹣300℃之间,主要原因是 . 焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是 .
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有 .
(4)“沉锂”的化学反应方程式为 .
(5)“沉锂”需要在95℃以上进行,主耍原因是 . 过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有和 .