题目内容
下列说法正确的是( )
A.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中一定无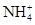 |
| B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体 |
| C.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色 |
| D.46 g NO2和N2O4混合气体中含有原子总数为3NA,含有的分子总数为NA |
B
由于氨气极易溶于水,若铵盐和强碱在稀溶液中反应且不加热时,产生的氨气不会挥发出来,红色石蕊试纸就不会变蓝色,A错;在酸性溶液中 具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2,B正确;Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,所以滴入KSCN溶液不可能显红色,C错;假设46 g气体全为NO2,则其含有的原子数为3NA,含有的分子数为NA,实际存在反应2NO2(g)
具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2,B正确;Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,所以滴入KSCN溶液不可能显红色,C错;假设46 g气体全为NO2,则其含有的原子数为3NA,含有的分子数为NA,实际存在反应2NO2(g)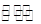 N2O4(g),导致分子数减少,原子数不变,D错。
N2O4(g),导致分子数减少,原子数不变,D错。
 具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2,B正确;Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,所以滴入KSCN溶液不可能显红色,C错;假设46 g气体全为NO2,则其含有的原子数为3NA,含有的分子数为NA,实际存在反应2NO2(g)
具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2,B正确;Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,所以滴入KSCN溶液不可能显红色,C错;假设46 g气体全为NO2,则其含有的原子数为3NA,含有的分子数为NA,实际存在反应2NO2(g)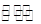 N2O4(g),导致分子数减少,原子数不变,D错。
N2O4(g),导致分子数减少,原子数不变,D错。
练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
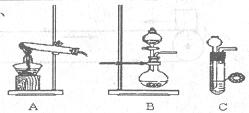
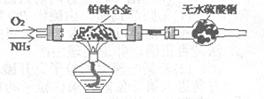
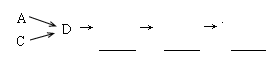
 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。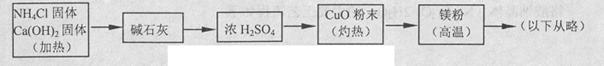
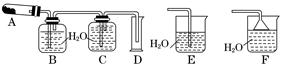

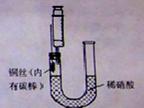
 N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。