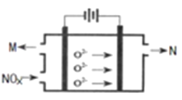
题目内容
【题目】已知反应①2BrO3-+Cl2=Br2+2ClO3-;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3-+5Cl-+6H+=3Cl2+3H2O。下列物质氧化能力强弱顺序正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】D
【解析】
化合价降低的是氧化剂,发生还原反应,得到还原产物,化合价升高的是还原剂,发生氧化反应,得到氧化产物,氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,则
①中BrO3-是氧化剂,ClO3-是氧化产物,所以氧化性BrO3-> ClO3-,
②中Cl2是氧化剂,HIO3是氧化产物,所以氧化性Cl2>HIO3,
③中ClO3-是氧化剂,是Cl2氧化产物,所以氧化性ClO3->Cl2,
综上得氧化性顺序为![]()
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)合成氨反应。
已知,氨的分解反应:2NH3(g) N2(g)+3H2 (g),活化能Ea=600kJmol-1,合成氨有关化学键的键能如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
则合成氨反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)的活化能Ea=________。
H2(g)NH3(g)的活化能Ea=________。
(2)已知2NO+O2=2NO2反应历程分两步
方程式 | 活化能 | 焓变 | |
总反应 | 2NO(g)+O2(g)=2NO2(g) |
| △H<0 |
第一步(快速平衡) | 2NO(g)N2O2(g) | Ea1 | △H1 |
第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:![]() ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数![]() ________(用
________(用![]() 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。
②用NO表示总反应的速率方程为![]() ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为![]() ,
,![]() 与
与![]() 是速率常数,则
是速率常数,则![]() ________。
________。
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是________。
A.![]() B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
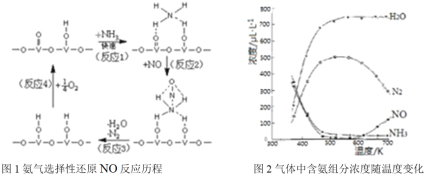
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式_______,该反应的含氮气体组分随温度变化如图2所示,当温度大于600K时,可能发生副反应的化学方程式_________。
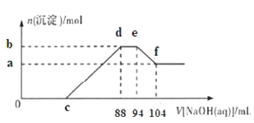
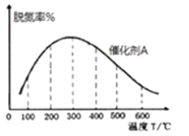
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线______________。
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为_________。