题目内容
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位的为铜、铝、铅、锌、镍。回答下列问题。
(1)铜原子的电子占有________种能量不同的原子轨道;在元素周期表中铝和铅元素处于周期表的_____区。
(2)配合物分子内(如图)的化学键有____________(填序号)。
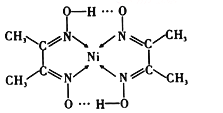
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH![]() CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
(4)硫酸锌是最重要的锌盐,为无色斜方晶体或白色粉末,其七水合物(ZnSO4·7H2O) 俗称皓矾,是一种天然矿物。请在SO42-的立体结构图(如图)中,描画出氧原子(用实心圆点“![]() ”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。
①下列关于该贮氢材料及氢气的说法,正确的是__________(填序号)。
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
C.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
D.该材料贮氢时采用常温高压比采用常温常压更好
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
②该合金的晶胞如图所示,属六方晶系,底面夹角为60°(120°),经测定晶胞参数a=511pm,c=397pm,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上,该晶体的化学式为_______________。若每个晶胞可吸收3个H2,则储氢后(氢进入晶胞空隙,体积不变)该晶胞的密度计算式为___________________________。(NA表示阿伏加德罗常数)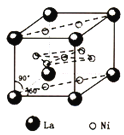
【答案】 7 p CE ② 平面三角 ![]() BD LaNi5
BD LaNi5 ![]() 或
或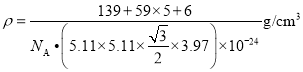 (其他合理答案均给分)
(其他合理答案均给分)
【解析】(1)基态铜原子的电子排布式为1s22s22p63s23p63d104s1,有7个能级,所以占有7种能量不同的原子轨道;在元素周期表中铝和铅元素原子的价电子排布分别为3s23p1和6s26p2,故其处于周期表的p区。
(2)该配合物的中心原子为Ni2+与4个N原子之间形成配位键,其他化学键为共价键,故其分子内的化学键有共价键和配位键,填CE。
(3)①CH2=CH2、②CH![]() CH、③苯、④HCHO等,他们的C原子的杂化类型分别为sp2、sp、sp2、sp2,σ键与π键比值分别是5:1、3:2、12:1、3:1,所以,其中分子中C原子为sp杂化的是②,σ键与π键比值为3∶1的是④HCHO,HCHO中心原子为sp2杂化的C原子,故其分子的立体结构为平面三角形。
CH、③苯、④HCHO等,他们的C原子的杂化类型分别为sp2、sp、sp2、sp2,σ键与π键比值分别是5:1、3:2、12:1、3:1,所以,其中分子中C原子为sp杂化的是②,σ键与π键比值为3∶1的是④HCHO,HCHO中心原子为sp2杂化的C原子,故其分子的立体结构为平面三角形。
(4)SO42-的空间构型为正四面体,故其立体结构图为![]() 。
。
(5)①下列关于该贮氢材料及氢气的说法:A.该材料中镧原子和镍原子之间存在金属键,是金属晶体,A不正确;B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子,B正确;C.氢分子被吸收时首先要在合金表面解离变成氢原子,破坏共价键要吸收热量,B不正确;D.该材料贮氢过程中,气体分子数减少,故高压比常压有利于储氢,D正确。综上所述,正确的是BD。
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
②由该晶胞的结构示意图可知,其中La和Ni的原子个数分别为1(![]() )和5(
)和5(![]() ),所以,该晶体的化学式为LaNi5。若每个晶胞可吸收3个H2,则储氢后晶体的化学式为H6 LaNi5,NA个晶胞的质量和体积分别为
),所以,该晶体的化学式为LaNi5。若每个晶胞可吸收3个H2,则储氢后晶体的化学式为H6 LaNi5,NA个晶胞的质量和体积分别为![]() 和
和![]() ,故该晶胞的密度计算式为
,故该晶胞的密度计算式为![]() 或
或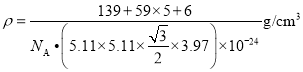 。
。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案