��Ŀ����
����Ŀ��I�� ��ͼ��ʾ��U�ιܵ���˱�ˮ�ͽ�������м���������������Ϊ1��4���Ļ�����壬�ٶ�������ˮ�е��ܽ�ȿ��Ժ��ԣ�������м���������Ļ�������װ�÷������й�ĵط����û�����建���ط�Ӧһ��ʱ�䡣

��1����������������������Ϊ1��4����Ӧ��֣���ֻ����һ���л����д����ѧ����ʽ____________________________________��
��2����������Сʱ�ķ�Ӧ��U�ι��Ҷ˵IJ�������ˮ���仯��______������ĸ��ţ�
A������ B������ C������ D����ȷ��
II ����ʵ��������ȡ��ϩ�ķ�ӦΪ��![]() �������¶ȿ��Ʋ�������������Ӧ�����������ͼʵ����ȷ�������������������ϩ�Ͷ�������
�������¶ȿ��Ʋ�������������Ӧ�����������ͼʵ����ȷ�������������������ϩ�Ͷ�������

��3����ϩʹ��ˮ��ɫ�Ļ�ѧ����ʽ��______________________________��
��4��I ��II��III����װ�ÿ�ʢ�ŵ��Լ��ǣ���������ĸ���ţ���
I ______�� II ______�� III ______�� �� ______��
A��Ʒ����ҺB��NaOH��ҺC��ŨH2SO4 D����ˮ
��5��ȷ�Ϻ�����ϩ�������� _________________________________��
���𰸡�![]() B
B![]() ABADװ��III����Һ����ɫ��װ��IV����Һ��ɫ
ABADװ��III����Һ����ɫ��װ��IV����Һ��ɫ
��������
����������ڹ��յ������¿��Է���ȡ����Ӧ������һ�ȼ��顢���ȼ��顢���ȼ��������Ȼ�̼���Ȼ��⣬һ�ȼ�����Ȼ��������壬�ȴ��鲻����ˮ���Ȼ��⼫������ˮ��Ҫ֤������������ϩ�Ͷ�������Ӧ�ȸ��ݶ��������Ư���Լ����������Ȼ��������������Һ��ȥ���������������ˮ������ϩ��
I����1����������������������Ϊ1��4����Ӧ��֣���ֻ����һ���л����Ӧ����Ϊ���Ȼ�̼���Ȼ��⣬�÷�Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2����������Сʱ�ķ�Ӧ�����Ȼ�������ˮ������Һ̬���ﵼ�������ѹ��С����U�ι��Ҷ˵IJ�������ˮ���½���ѡB ��
II ����3����ϩʹ��ˮ��ɫ�Ļ�ѧ����ʽ��![]() ��
��
��4����ʵ��Ŀ�Ŀ�֪��I���ڼ����������ͨ����Ʒ����Һ��II�������ն�������ͨ����NaOH��Һ��III���ڼ���������Ƿ��������Ʒ����Һ��IV���ڼ�����ϩ������ˮ������I��II��III��IVװ�ÿ�ʢ�ŵ��Լ���A��B��A��D��
��5��ȷ�Ϻ�����ϩ����������װ��III����Һ����ɫ��װ��IV����Һ��ɫ��

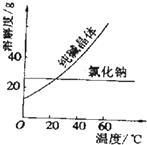
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������գ�
��1����ͼ1�dz��������IJ��ֽṹ��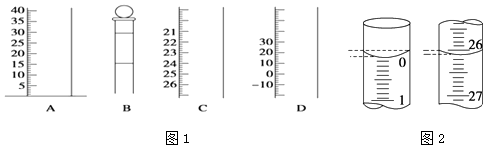
�����������BC
��ʹ��ǰ�����Ƿ�©ˮ�������� ��
��2���ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע�� �� �ζ��յ�ʱ����ƿ����ɫ�仯Ϊ �� �Ұ��������ɫ����ԭ��
��3�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��4�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ2��ʾ������������Һ�����ΪmL��
��5��ijѧ������3��ʵ��ֱ��¼�й����������
�ζ� | ����NaOH��Һ�����/mL | 0.100 0mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 25.11 | 25.11 |
�ڶ��� | 25.00 | 0.56 | 30.56 | 30.00 |
������ | 25.00 | 0.22 | 25.11 | 24.89 |
���ݱ�������ʽ�����NaOH��Һ�����ʵ���Ũ�� �� ��������λ��Ч���֣�
����Ŀ���Ķ������������������ϣ�
����һ����ͼ
���϶������
���� | �۵�/�� | �е�/�� | �ܶ�/gcm��3 | �ܽ��� |
�Ҷ���C2H6O2 | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������C3H8O3 | 17.9 | 290 | 1.26 | ��ˮ���ƾ�������Ȼ��� |
�����������ϼ��α�֪ʶ���ش��������⣨ÿ��ֻ��һ����ĸѡ�����
A������ B����ȡ�� C�����ܽ⡢�ᾧ�����ˡ��ķ��� D����Һ��
��1���������ͺ�ˮ����ѷ�������
��2��ȥ�������е������Ȼ������ʣ����Ӧ����
��3�����Ҷ����ͱ�������������ѷ����� ��