��Ŀ����
����Ŀ����NA�ǰ����ӵ�������ֵ������˵����ȷ����
A. ��״���£�6.0gNO��2.24LO2�Ļ������������������Ϊ0.3NA
B. �����£���0.1molFe���뺬0.8molHNO3��Ũ�����У���Ӧת�Ƶĵ�����Ϊ0.3NA
C. 32gS8�����У�Sԭ�Ӿ�����8�����ȶ��ṹ�����е�SһS����Ϊ![]() NA
NA
D. 1L0.1mol/LNa2S��Һ�У������Ӻ������ӵ���Ŀ��С��2:1
���𰸡�D
��������A. ��״���£�6.0gNO��2.24LO2�����ʵ����ֱ�Ϊ0.2mol��0.1mol������ǡ�÷�Ӧ����0.2mol NO2���������������������Ϊ0.2NA��A����ȷ��B. �����£���0.1molFe���뺬0.8molHNO3��Ũ�����У��������ۻ���������÷�Ӧ��ת�Ƶĵ�������B����ȷ��C. S8������8��Sԭ���γɰ�Ԫ������������8��SһS����32gS8�����ʵ���Ϊ1mol�����ԣ�32gS8�����к��е�SһS����ΪNA��C����ȷ��D. Na2S��Һ��S2������ˮ������HS����OH������������Ŀ���࣬����1L0.1mol/LNa2S��Һ�У������Ӻ������ӵ���Ŀ��С��2:1��D��ȷ������ѡD��

����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������գ�
��1����ͼ1�dz��������IJ��ֽṹ��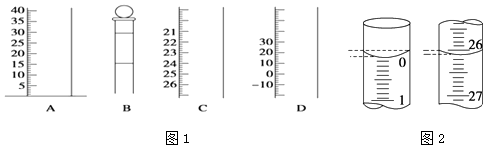
�����������BC
��ʹ��ǰ�����Ƿ�©ˮ�������� ��
��2���ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע�� �� �ζ��յ�ʱ����ƿ����ɫ�仯Ϊ �� �Ұ��������ɫ����ԭ��
��3�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��4�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ2��ʾ������������Һ�����ΪmL��
��5��ijѧ������3��ʵ��ֱ��¼�й����������
�ζ� | ����NaOH��Һ�����/mL | 0.100 0mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 25.11 | 25.11 |
�ڶ��� | 25.00 | 0.56 | 30.56 | 30.00 |
������ | 25.00 | 0.22 | 25.11 | 24.89 |
���ݱ�������ʽ�����NaOH��Һ�����ʵ���Ũ�� �� ��������λ��Ч���֣�
����Ŀ���Ķ������������������ϣ�
����һ����ͼ
���϶������
���� | �۵�/�� | �е�/�� | �ܶ�/gcm��3 | �ܽ��� |
�Ҷ���C2H6O2 | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������C3H8O3 | 17.9 | 290 | 1.26 | ��ˮ���ƾ�������Ȼ��� |
�����������ϼ��α�֪ʶ���ش��������⣨ÿ��ֻ��һ����ĸѡ�����
A������ B����ȡ�� C�����ܽ⡢�ᾧ�����ˡ��ķ��� D����Һ��
��1���������ͺ�ˮ����ѷ�������
��2��ȥ�������е������Ȼ������ʣ����Ӧ����
��3�����Ҷ����ͱ�������������ѷ����� ��