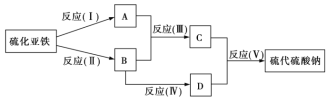
题目内容
【题目】![]() 与浓硝酸反应生成氮氧化物,这些氮氧化物溶解在
与浓硝酸反应生成氮氧化物,这些氮氧化物溶解在![]() 溶液中生成
溶液中生成![]() 和
和![]() 的混合溶液,反应过程及有关数据如图所示:
的混合溶液,反应过程及有关数据如图所示:
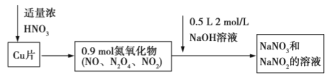
下列有关判断正确的是( )
A.若![]() 片为
片为![]() ,则生成
,则生成![]()
B.![]() 遇浓硝酸发生钝化,不可能发生上述反应
遇浓硝酸发生钝化,不可能发生上述反应
C.标准状况下收集的氮氧化物为![]()
D.![]() 既是氧化产物,也是还原产物
既是氧化产物,也是还原产物
【答案】A
【解析】
A. n(Cu)=![]() 0.8mol,n(NaOH)=0.5L×2mol/L=1mol,由电子守恒可知,51.2gCu失去的电子等于HNO3→NaNO2得到的电子,则0.8mol×(2-0)=n(NaNO2)×(5-3),解得n(NaNO2)=0.8mol,由Na原子守恒可知n(NaOH)= n(NaNO2)+ n(NaNO3),则n(NaNO3)=1mol-0.8mol=0.2mol,故A正确;
0.8mol,n(NaOH)=0.5L×2mol/L=1mol,由电子守恒可知,51.2gCu失去的电子等于HNO3→NaNO2得到的电子,则0.8mol×(2-0)=n(NaNO2)×(5-3),解得n(NaNO2)=0.8mol,由Na原子守恒可知n(NaOH)= n(NaNO2)+ n(NaNO3),则n(NaNO3)=1mol-0.8mol=0.2mol,故A正确;
B.常温下,Cu遇浓硝酸不能钝化,故B错误;
C.标准状况下得到的0.9mol氮氧化物的体积是0.9mol×22.4L/mol=20.16L,因为NO2和N2O4之间存在转化平衡,且标准状况下NO2和N2O4不是气体,所以体积小于20.16,故C错误;
D.反应过程中Cu→Cu(NO3)2,只有铜元素化合价升高,Cu(NO3)2是氧化产物,不是还原产物,故D错误。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】某无色混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Al3+、NH4+、Na+ |
可能大量含有的阴离子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
为探究其成分,进行了以下探究实验。
探究一:
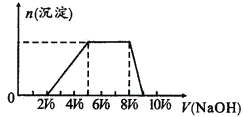
甲同学取一定量的混合溶液,用pH试纸检验,溶液pH<7;向其中逐液加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
探究二
乙同学取一定量的混合溶液,向溶液中加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
探究三:
另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
(1)该溶液中一定含有的阴离子是___;其中能确定离子浓度之比的,对应离子物质的量浓度之比为___;不能肯定是否含有的离子是___。确定其中阳离子的实验方法为___。
(2)请写出沉淀减少过程中发生反应的离子方程式___。
【题目】下列实验中“实验内容”与对应“实验现象和结论”的关系都正确的是( )
选项 | 实验内容 | 实验现象和结论 |
A | 向FeCl3+3KSCN | 溶液的血红色变浅,说明增加生成物浓度,平衡逆移 |
B | 分别往甲:4mL0.1mol·L-1、乙:4mL0.2mol·L-1的酸性KMnO4溶液中加入2mL0.1mol·L-1H2C2O4溶液,记录褪色时间 | 乙先褪色,说明反应物浓度越大,反应速率越快,越先褪色 |
C | 室温下,5mL0.1mol·L-1Na2S2O3溶液中加入5mL0.1mol·L-1稀H2SO4溶液,观察现象 | 溶液立即出现浑浊,说明不可逆反应是瞬间完成的 |
D | 向饱和硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液 | 无明显现象酸性:H3BO3<H2CO3 |
A.AB.BC.CD.D