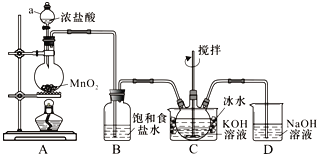
题目内容
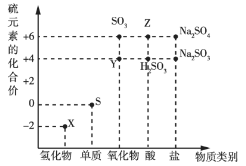
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C是常见的强酸,B是黄色非金属单质;E是紫红色金属单质,G是最常见的无色液体;D、F、I是常见的气体,D为红棕色,D与I组成元素相同,且相对分子质量相差16。
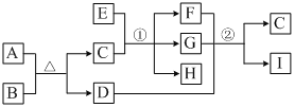
请回答下列问题:
(1)G的化学式为________。
(2)反应①的化学方程式为_____________________________。
(3)E与A的浓溶液反应的离子方程式为_________________________________。
(4)反应②的化学方程式为_____________________________________。
【答案】H2O Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O Cu+4H++2NO3—=== Cu2++2NO2↑+2H2O SO2+NO2+H2O=== H2SO4+NO
CuSO4+SO2↑+2H2O Cu+4H++2NO3—=== Cu2++2NO2↑+2H2O SO2+NO2+H2O=== H2SO4+NO
【解析】
由题意和转化关系可知,E是紫红色的金属单质,则E为Cu;A、C是常见的强酸,黄色非金属单质B与A反应得到C和D,D为红棕色气体,且C能与Cu反应生成F、G、H,且G是最常见的无色液体可知A为HNO3、B为S、C为H2SO4、D为NO2、G为H2O、H为CuSO4;D与I组成元素相同,且相对分子质量相差16,而D、F、G反应得到C和I,则F为SO2、I为NO。
(1)由分析可知,G为水,化学式为H2O,故答案为:H2O;
(2)反应①为铜和浓硫酸共热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为Cu+4H++2NO3—= Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3—= Cu2++2NO2↑+2H2O;
(4)反应②为二氧化硫与二氧化氮和水发生氧化还原反应生成硫酸和一氧化氮,反应的化学方程式为SO2+NO2+H2O=H2SO4+NO,故答案为:SO2+NO2+H2O=H2SO4+NO。

 阅读快车系列答案
阅读快车系列答案