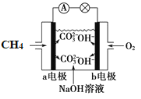
题目内容
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
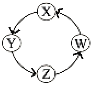
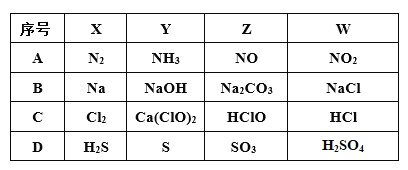
A. AB. BC. CD. D
【答案】D
【解析】
A. 氮气与氢气反应可以一步制得氨气,氨气与氧气发生催化氧化可一步得到一氧化氮,NO与氧气反应可一步得到NO2,二氧化氮与一氧化碳反应可得到氮气(汽车尾气处理装置);
B. Na与水反应可得到NaOH,NaOH与二氧化碳反应可得到碳酸钠,碳酸钠与氯化钡反应可得到氯化钠,电解熔融氯化钠可得到钠单质;
C. 氯气可与氢氧化钙反应得到次氯酸钙,次氯酸钙可与水和二氧化碳反应得到HClO,HClO分解可得HCl,浓盐酸与二氧化锰反应可得到氯气;
D. 硫化氢被氧化可得到硫单质,硫单质无法一步反应制得SO3,三氧化硫溶于水可得到H2SO4;
故答案选D。

 寒假学与练系列答案
寒假学与练系列答案【题目】Ⅰ.K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__;往上述溶液中加入氢氧化钠溶液现象为___;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着__这种改变的方向移动。
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__;往上述溶液中加入氢氧化钠溶液现象为___;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着__这种改变的方向移动。
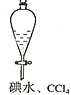
Ⅱ. 为了证明化学反应有一定的限度,利用铁离子可以氧化碘离子的反应进行了如下探究活动:
(1)步骤1:取8mL0.1molL﹣1的KI溶液于试管,滴加0.1molL﹣1的FeCl3溶液5~6滴,振荡;
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加5~6滴0.1molL﹣1___(试剂名称),振荡,未见溶液呈血红色。
(2)探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:________________
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:Fe3+可与[Fe(CN)6]4﹣反应生成蓝色沉淀,反应的离子方程式为___,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
信息二:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
结合新信息,请你完成以下实验:各取少许步骤3的水溶液分别于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:①___________ | ②______ | 则“猜想一”不成立 |
实验2:在试管B加入少量乙醚,充分振荡,静置 | ③______ | 则“猜想二”成立 |