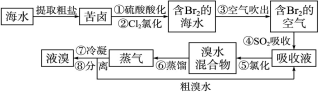
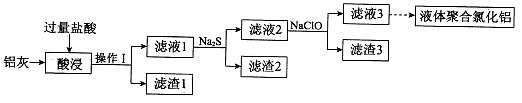
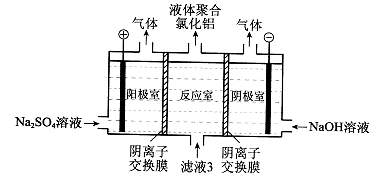
题目内容
“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂。其化学名称为“乙酸三氯甲基苯甲酯”通常用三氯甲基苯基甲醇和醋酸酐为原料制备:
已知:
| 三氯甲基苯基甲醇 | 式量:224.5。无色液体。不溶于水,溶于乙醇。 |
| 醋酸酐 | 无色液体。溶于水形成乙酸,溶于乙醇。 |
| 结晶玫瑰 | 式量:267.5。白色至微黄色晶体。熔点:88℃。不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g。 |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇。 |

请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并 。待混合均匀后,最适宜的加热方式为 (填“水浴加热”或“油浴加热”)。
(2)粗产品的成分是结晶玫瑰与少量____________________的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在 中,按粗产品、溶剂的质量比为1: 混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
| ② | 将步骤1所得溶液___________ | | |
| ③ | 干燥步骤2所得白色晶体, | __________________ | 白色晶体是结晶玫瑰 |


由信息可知,从高温浓溶液中获得较大晶体的操作为 。
(4)22.45g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是____。(保留两位有效数字)
(1)搅拌; 油浴加热 (2)三氯甲基苯基甲醇序号 实验方案 实验现象 结论 无水乙醇 ;100/a ② 冷却结晶,抽滤。 ③ 加热使其融化,测其熔点; 白色晶体在88℃左右、完全熔化
(3)加入晶种,缓慢降温 (4)85%
解析试题分析:(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并不断用玻璃棒搅拌,使物质充分接触。待混合均匀后,由于反应温度在110℃,所以要采用110℃油浴加热的方式进行加热。(2)待反应完全后,反应液倒入冰水中降温,由于结晶玫瑰熔点为88℃,不溶于水;醋酸酐溶于水形成乙酸,而三氯甲基苯基甲醇不能在水中溶解,所以粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇。①结晶玫瑰与三氯甲基苯基甲醇都能在乙醇中溶解,所以将粗产品溶解在乙醇中,结晶玫瑰在70℃时在乙醇中溶解度为a g。所以按粗产品、溶剂的质量比为1: 100/a混合,用水浴加热到70℃回流溶剂使粗产品充分溶解。②将步骤1所得溶液进行冷却结晶,然后抽滤即可得到较纯净的结晶玫瑰。③干燥步骤2所得白色晶体,加热测其熔点,看到白色晶体在白色晶体在88℃左右、完全熔化。就证明了该白色晶体是结晶玫瑰。(3)由信息可知,从高温浓溶液中获得较大晶体的操作为加入晶种,缓慢降温。(4)三氯甲基苯基甲醇的物质的量为22.45g ÷225.5g/mol=0.0996mol,所以理论上得到的结晶玫瑰质量为0.0996mol ×267. 5g/mol =26.63g.而实际得到的质量为22.74g,所以产率为(22.74g÷26.63g)×100% =85%。
考点:考查反应条件的选择、物质在检验纯度的过程中的操作及现象的分析、纯度的计算的知识。

下列有关物质除杂的方法中可行的是
| A.除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 |
| B.向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液,以除去FeC12溶液中的FeBr2 |
| C.除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 |
| D.巳知:Ksp (CuS)<Ksp (FeS),可加入过量的难溶电解质FeS,使水中少量的Cu2+转化成硫化物沉淀而除去 |
下列提纯物质(括号中为杂质)的试剂和分离方法正确的是
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| D | 甲苯(苯酚) | 浓溴水 | 过滤 |
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下: 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)2 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。 ②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式 。
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下: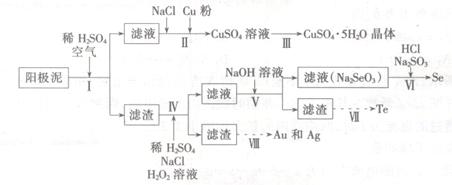
已知:①阳极泥的主要化学成分,如表1所示
表一
| 主要成份 | Cu Ag Au Se Te |
| 百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| | 固定浸出温度 | | | 固定H2SO4浓度 |
| H2SO4浓度 mol/L | 浸出率/% | | 浸出温度/℃ | 浸出率/% |
| Cu Ag Au Se Te | | Cu Ag Au Se Te | ||
| 4 | 95.1 4.67 <0.2 0.83 8.93 | | 30 | 87.1 4.58 <0.2 0.08 6.83 |
| 3 | 94.5 4.65 <0.2 0.28 6.90 | | 40 | 94.5 4.65 <0.2 0.28 6.90 |
| 2 | 78.1 2.65 <0.2 0.05 2.85 | | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为 ;此过程中H2O2溶液的添加量要远远高于理论值,原因为 。
(5)步骤Ⅵ中所发生反应的化学方程式为 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 B.浓盐酸 C.浓氢氡化钠溶液 D.王水