题目内容
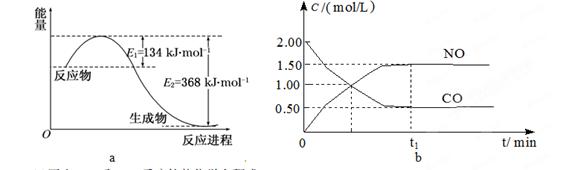
(14分)图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则:α1+α2= , a+b/2= ,m=

(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
则:α1+α2= , a+b/2= ,m=
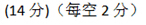
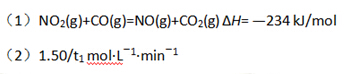
(3) 9 ; 变大
(4) 1 ; 234 ; 3
试题分析:(1)根据能量变化图,反应热等于生成物的总能量减去反应物的总能量,反应物和生成物能量的差值为E2-E1,写出化学方程式,标出各物质的状态,从而写出热化学方程式;(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据v=
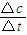 计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大;(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1; 令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ乙中吸收的热量为2n×234kJ=bkJ,整理得a+
计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大;(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1; 令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ乙中吸收的热量为2n×234kJ=bkJ,整理得a+ =234;丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
=234;丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
练习册系列答案
相关题目
 2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1 O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1 O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1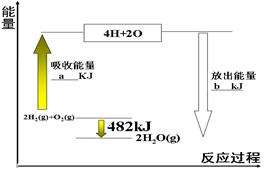
 O2(g)
O2(g) CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol