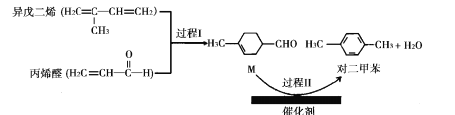
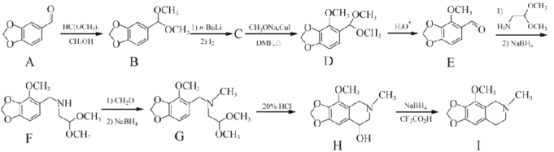
题目内容
【题目】下列关于电解质溶液的说法正确的是
A.0.1 L 0.5 mol·L-1 CH3COOH溶液中含有的H+数为0.05NA
B.室温下,稀释0.1 mol·L-1 CH3COOH溶液,溶液的导电能力增强
C.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中所有离子浓度均减小
D.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
【答案】D
【解析】
A.若醋酸为强酸,则0.1 L 0.5 mol·L-1 CH3COOH溶液中含有的H+数为0.05NA,但醋酸为弱酸,不完全电离,所以H+数小于0.05NA,故A错误;
B.0.1 mol·L-1 CH3COOH溶液为醋酸的稀溶液,再加水稀释溶液中的离子浓度减小,导电能力减弱,故B错误;
C.0.1 mol·L-1 CH3COOH溶液中加入少量水溶液的酸性减弱,氢离子浓度减小,则氢氧根浓度增大,故C错误;
D.![]() =
=![]() ,加水稀释氢离子浓度减小,Ka不变,所以该比值减小,故D正确;
,加水稀释氢离子浓度减小,Ka不变,所以该比值减小,故D正确;
故答案为D。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目