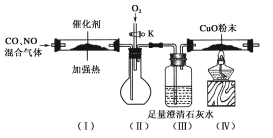
题目内容
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如下:
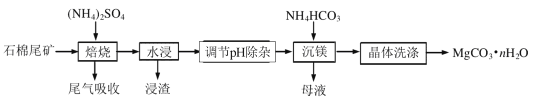
已知“焙烧”过程中的主反应为:
![]()
(1)写出焙烧产物NH3的电子式_____________________。
(2)为提高水浸速率,可采取的措施为_______________________(任写一条),“浸渣”的主要成分为__________________。
(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是______________,此时溶液中的c(Fe3+)=__________________(已知Ksp[Fe(OH)3]=4.0×10-38)。
(4) “沉镁”过程中反应的离子方程式为_______________________________________。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是________________
【答案】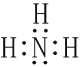 将焙烧渣粉碎或加热或搅拌SiO2Fe3+、Al3+4.0×10-11mol/LMg2++2HCO-+(n-1)H2O=MgCO3nH2O↓+CO2↑升温促进Mg2+部分水解或升温促进Mg2+水解
将焙烧渣粉碎或加热或搅拌SiO2Fe3+、Al3+4.0×10-11mol/LMg2++2HCO-+(n-1)H2O=MgCO3nH2O↓+CO2↑升温促进Mg2+部分水解或升温促进Mg2+水解
【解析】
以石棉尾矿(主要含有Mg3 ( Si2O5)(OH)4和少量的Fe2O3、Al2O3)为原料制备碳酸镁晶体(MgCO3nH2O)的工艺流程:加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,形成Mg2+、Fe3+、Al3+的溶液,SiO2不溶于水形成浸渣,加入NH3H2O将pH调至8.0左右,将Fe3+、Al3+以氢氧化物的形式过滤除去,向含有镁离子的滤液中加入碳酸氢铵发生反应:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑,洗涤晶体可得,据此分析解答。
(1)氨气为共价化合物,电子式为: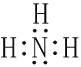 ;(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,SiO2不溶于水形成浸渣;故答案为:将焙烧渣粉碎或加热或搅拌;SiO2;(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是Fe3+、Al3+;此时溶液中c(OH-)=10-9mol/L,Ksp[Fe(OH)3]= c(Fe3+) c3(OH-)= c(Fe3+)×(10-9mol/L)3 =4.0×10-38,则c(Fe3+)=4.0×10-11mol/L;(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑;“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是升温促进Mg2+部分水解或升温促进Mg2+水解。
;(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,SiO2不溶于水形成浸渣;故答案为:将焙烧渣粉碎或加热或搅拌;SiO2;(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是Fe3+、Al3+;此时溶液中c(OH-)=10-9mol/L,Ksp[Fe(OH)3]= c(Fe3+) c3(OH-)= c(Fe3+)×(10-9mol/L)3 =4.0×10-38,则c(Fe3+)=4.0×10-11mol/L;(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑;“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是升温促进Mg2+部分水解或升温促进Mg2+水解。