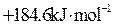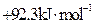题目内容
在密闭容器中充入4mol SO2和3mol O2,在一定条件下建立平衡:2SO2(g)+O2(g)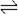 2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
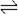 2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )| A.1.8△H | B.2△H | C.△H | D.0.9△H |
A
略

练习册系列答案
相关题目


 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。 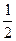 O2(g) = H2O(g) ΔH1=a kJ·mol-1?
O2(g) = H2O(g) ΔH1=a kJ·mol-1? 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。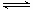 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。 __。
__。 +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
+1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol 1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
1/2O2(g)==H2O(g); △H=-241.8 kJ/mol O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol  则反应
则反应 的
的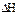 为
为