题目内容
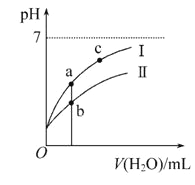
【题目】巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
【答案】D
【解析】A. 酸性:CH3COOH>HClO,所以水解程度:CH3COONa<NaClO,因此,相同浓度CH3COONa和NaClO的混合液中各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;B. 酸性:H2CO3>HClO> HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-,故B错误;C. 图像中pH变化较快的酸的酸性较强,浓度较小,所以a点酸的总浓度小于b点酸的总浓度,故C错误;D. 图像中a、c两点处的溶液中盐的水解常数相等,所以![]() 相等,故D正确。故选D。
相等,故D正确。故选D。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向浓度均为l×10-3mol/L的KCl和K2CrO4混合液中滴加l×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
C. 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5