题目内容
【题目】合理处理燃气中的H2S,不仅可资源化利用H2S,还可减少对大气的污染。回答下列问题:
(1)反应2H2S(g)=2H2(g)+S2(g) ΔH=+171.59 kJ·mol-1,该反应可在____(填“低温”“高温”或“任何温度”)下自发进行。
(2)利用H2S代替H2O通过热化学循环可高效制取H2,原理如图a所示:
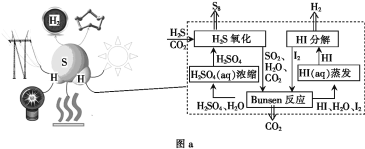
①“Bunsen反应”的离子方程式为________。
②已知键能E(I—I)=152.7 kJ·mol-1,E(H—H)=436.0 kJ·mol-1,E(H—I)=298.7 kJ·mol-1,HI气体分解为碘蒸气和氢气的热化学方程式为________。
③上述循环过程总反应方程式为________。
(3)Ahmed Daham Wiheeb等介绍的一种燃料电池的装置如图b所示:
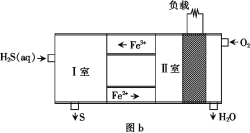
通入O2的电极为________(填“正极”或“负极”),每消耗3.36 L(标准状况下)O2,理论上消耗H2S的质量为____。
(4)为探究H2S直接热解[H2S(g) ![]() H2(g)+
H2(g)+![]() S2(g)],在一密闭容器中充入1 mol H2S与4 mol N2(N2不参与反应),维持总压在101 kPa下进行实验,图c是不同温度下反应时间与H2S的转化率的关系,图d是平衡时气体组成与温度的关系。
S2(g)],在一密闭容器中充入1 mol H2S与4 mol N2(N2不参与反应),维持总压在101 kPa下进行实验,图c是不同温度下反应时间与H2S的转化率的关系,图d是平衡时气体组成与温度的关系。
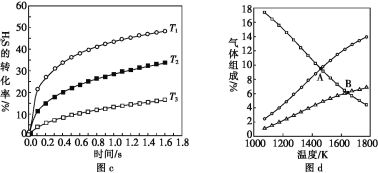
①图c中温度由高到低的顺序是________。
②图d中A点H2S的平衡转化率为______,B点时反应的平衡常数Kp=____(已知![]() ≈10)。
≈10)。
【答案】高温 SO2+I2+2H2O=4H++2I-+SO42- 2HI(g) ![]() H2(g)+I2(g) ΔH=+8.7 kJ·mol-1 8H2S
H2(g)+I2(g) ΔH=+8.7 kJ·mol-1 8H2S![]() 8H2+S8 正极 10.2 g T1>T2>T3 50% 5
8H2+S8 正极 10.2 g T1>T2>T3 50% 5
【解析】
判断反应能否自发进行,根据自由能判据△G=△H-T△S,△G<0才能自发进行;而在分析循环反应的流程图时,要看箭头方向和进来、出去的物质,找出循环的物质,分析总反应,上述流程图中,进入的是H2S和CO2,出来的是H2和S8以及CO2,可分析出是H2S分解成了H2和S8。
(1)反应的焓变△H>0,△S>0,要使得△H-T△S<0,则需要在高温下进行反应,故答案为:高温;
(2)①“Bunsen反应”是SO2、I2、H2O反应生成H2SO4和 HI,故离子方程式为SO2+I2+2H2O=4H++2I-+SO42-,故答案为:SO2+I2+2H2O=4H++2I-+SO42-;
②反应热ΔH =反应物键能总和-生成物键能总和,故2HI(g)H2(g)+I2(g)的反应热为:298.7×2-436.0-152.7=8.7kJmol-1,故答案为:2HI(g) ![]() H2(g)+I2(g) ΔH=+8.7 kJ·mol-1;
H2(g)+I2(g) ΔH=+8.7 kJ·mol-1;
③上述流程图中,进入的是H2S和CO2,出来的是H2和S8以及CO2,可分析出是H2S分解成了H2和S8,故总反应方程式为8H2S![]() 8H2+S8,故答案为:8H2S
8H2+S8,故答案为:8H2S![]() 8H2+S8;
8H2+S8;
(3)该燃料电池是硫化氢失去电子,氧气得到电子,故通入O2的电极为正极,根据电子守恒,得出关系式:2H2S~O2,当氧气的物质的量为0.15 mol时,H2S为0.3mol,质量为0.3×34g=10.2g,故答案为:正极,10.2 g;
(4)①分解反应为吸热反应,温度越高,H2S的转化率越大,故答案为:T1>T2>T3:
②图d中A点表示H2S和H2的物质的量相等,根据方程式H2S(g) ![]() H2(g)+
H2(g)+![]() S2(g)可知H2S反应了一半,转化率为50%;B点时:
S2(g)可知H2S反应了一半,转化率为50%;B点时:
H2S(g) ![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
起始物质的量 1 0 0
改变的物质的量 2x 2x x
B点物质的量 1-2x 2x x
由图可知H2S的物质的量等于S2的物质的量,由等式1-2x= x,得x=![]() ,则B点气体总物质的量为(
,则B点气体总物质的量为(![]() +4)mol,B点H2S的物质的量为
+4)mol,B点H2S的物质的量为![]() mol,H2的物质的量为
mol,H2的物质的量为![]() mol,S2的物质的量
mol,S2的物质的量![]() mol, H2S的体积分数为=
mol, H2S的体积分数为=![]() ,H2的体积分数为
,H2的体积分数为![]() , S2的体积分数为
, S2的体积分数为![]() ,则平衡常数Kp=
,则平衡常数Kp=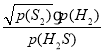 =
=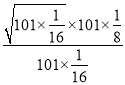 =5;故答案为:5。
=5;故答案为:5。

