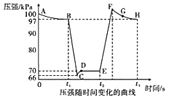
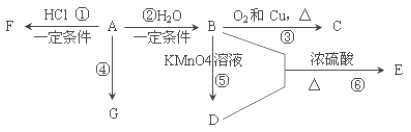
题目内容
【题目】下列有关仪器的使用或实验操作正确的是
A.用稀盐酸洗涤H2还原CuO后试管内壁的铜
B.蒸发时,蒸发皿中溶液的量不能超过总容量的![]()
C.分离苯萃取溴水后的分层液体,从分液漏斗下口先放出水层,再放出有机层
D.用KMnO4溶液测定Na2C2O4的浓度时,KMnO4溶液盛放在碱式滴定管中
【答案】B
【解析】
A、氢气还原氧化铜后留下的铜,是不活泼金属,排在金属活动性顺序中氢的后面,不能和稀盐酸反应,故A错误;
B、蒸发时,加入的液体不能超过容器容积的![]() ,过多液体可能溢出,故B正确;
,过多液体可能溢出,故B正确;
C、苯的密度比水的密度小,分层后水层在下层,分层时避免上下层液体混合,则先分离出水,有机层从上口倒出,故C错误;
D、高锰酸钾溶液呈酸性,且有强氧化性,要腐蚀橡皮,应该用酸式滴定管盛放,故D错误。
答案选B。

练习册系列答案
相关题目
【题目】根据下列实验现象,所得结论正确的是( )
实验 | 实验现象 | 结论 | |
A |
| 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B |
| 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C |
| 左边烧杯中无明显变化,右边烧杯中澄清石灰水变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
D |
| 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. AB. BC. CD. D