题目内容
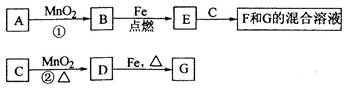
(已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质
①加热蒸干B的溶液不能得到B,则B的化学式可能是________________;工业上制取A的离子方程式为__________________________________。
②用A制备漂白粉的化学方程式是________________________________________________。反应②的离子方程式是______________________________________________________,配制C的溶液时可加入少量的______(填物质名称)以抑制水解。
(2)若A是某强酸的稀溶液,则A的化学式可能是________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________。
(4)若A、B、C的的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别这两种气态酸性氧化物常可选用________________(填一种试剂名称)。
(1) ①FeCl3 (2分) 2Cl-+2H2O 2OH-+Cl2↑+H2↑(2分)
2OH-+Cl2↑+H2↑(2分)
②2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分) Fe+2Fe3+=3Fe2+ (2分) 盐酸(2分)
(2)HNO3(2分,只要符合题意都给分)
(3)Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2- + 2H2O (2分)
(4)CO2 SO2 品红溶液、溴水或酸性高锰酸钾溶液等(共3分,每空1分。只要符合题意都给分)
解析试题分析:(1)根据D是生产、生活中用量最大、用途最广的金属单质可判断D为Fe。
①若A可用于自来水消毒,则A为Cl2。氯气与铁反应生成氯化铁,则B是氯化铁。工业上通过电解饱和食盐水制备氯气,所以工业上制取A的离子方程式为2Cl-+2H2O 2OH-+Cl2↑+H2↑。
2OH-+Cl2↑+H2↑。
②用氯气制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯化铁与铁反应生成氯化亚铁,则C为FeCl2,所以反应②的离子方程式为Fe+2Fe3+=3Fe2+。亚铁离子易水解,因此配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解。
(2)若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,因此可判断为HNO3。
(3)若D是氯碱工业的主要产品之一,B有两性,所以B为两性氢氧化物为Al(OH)3,因此D是氢氧化钠,所以能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,则反应②的离子方程式是Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2- + 2H2O。
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2。SO2具有漂白性和还原性,因此可以用品红溶液、溴水或酸性高锰酸钾溶液等鉴别。
考点:考查物质推断的有关判断

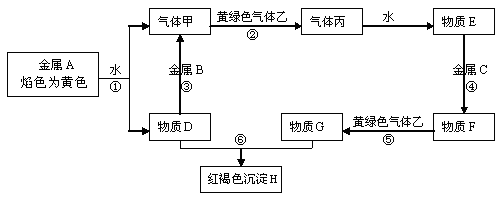
如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).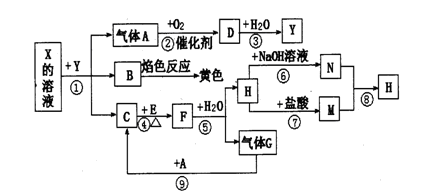
请回答下列问题:
(1)固体C的晶体类型是 ,F的化学式是 。
(2)工业上要实现A—D D—Y的转化需要的设备分别是 、 。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是 。
(4)反应⑧的离子方程式为 。
(5)正盐X中酸根离子中除氧元素外另一种元素的平均化合价可能为( )。
| A.+4价 | B.-2价 | C. 0价 | D.+2价 |
下列化学变化中,能够一步实现的是
| A.Na→Na2O2 | B.Al2O3→Al(OH)3 | C.N2→HNO3 | D.S→SO3 |
化学无处不在,下列与化学有关的说法正确的是( )
| A.液氨汽化时能吸收大量的热,故可用作制冷剂 |
| B.SO2能漂白纸浆等,故可广泛用于食品的漂白 |
| C.味精的主要成分是蛋白质,烧菜时可加入适量 |
| D.氢氟酸可用于雕刻玻璃制品,这是利用酸的通性 |