题目内容
将碱溶液A、盐溶液B按如下程序进行实验,根据下述现象判断: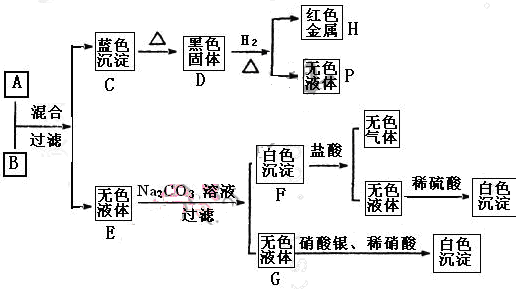
(1)A的化学式 B的化学式 。
(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D+H2=H+P:
(3) 写出下列反应的离子方程式:
A+B:
F+盐酸:
(4)盐溶液B中阴离子的检验方法是
(1)Ba(OH)2 CuCl2
(2)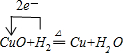
(3)Cu2++2OH-=Cu(OH)2↓ Ba CO3+2H+=Ba 2++CO2↑+H2O
(4)取少量B溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解。
解析试题分析:由转化关系图知,H为红色金属,则H为Cu,采用逆推法,D为黑色固体CuO,C为蓝色沉淀Cu(OH)2,P为H2O;采用正推法,碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E加Na2CO3溶液,过滤得无色溶液G,加硝酸银和稀硝酸产生白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2;由无色溶液E加Na2CO3溶液,过滤得白色沉淀F,加盐酸产生无色气体和无色溶液,白色沉淀F为碳酸盐,该无色溶液加硫酸产生白色沉淀,故无色溶液含有Ba2+,故白色沉淀为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2。
(1)由上述分析可知,A为Ba(OH)2;B为CuCl2;(2)D+H2→H+P为: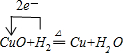 ;
;
(3)A+B反应是氢氧化钡与氯化铜反应生成氢氧化铜与氯化钡,反应离子方程式为:Cu2++2OH-=Cu(OH)2↓;F+盐酸是碳酸钡与元素反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O;(4)CuCl2溶液中阴离子的检验方法是:取少量B溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解,说明含有Cl-。
考点:以无机框图题的形式考查C、Cu、Cl、S等元素单质及其化合物之间的相互转化关系、离子检验。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
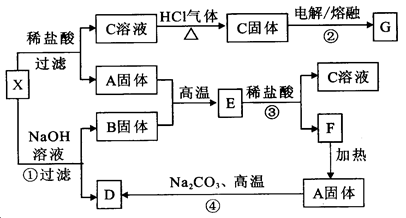
小学生10分钟应用题系列答案如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).
请回答下列问题:
(1)固体C的晶体类型是 ,F的化学式是 。
(2)工业上要实现A—D D—Y的转化需要的设备分别是 、 。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是 。
(4)反应⑧的离子方程式为 。
(5)正盐X中酸根离子中除氧元素外另一种元素的平均化合价可能为( )。
| A.+4价 | B.-2价 | C. 0价 | D.+2价 |
下列依据相关实验得出的结论正确的是 ( )
| A.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
| B.过量的铜屑与稀硝酸反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解,且有无色气体产生,铜可直接与1 mol/L稀硫酸反应 |
| C.将常温下呈气态的某有机物通入溴水中,溴水褪色,该气体分子中一定含碳碳双键或碳碳三键 |
| D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |