题目内容
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
| A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与bmol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b |
| C.0.1mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(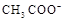 )+c( )+c(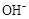 )<c(CH3COOH)+c(H+) )<c(CH3COOH)+c(H+) |
C D
试题分析:A、正确,CH3COOH>H2CO3>HCN>HCO3—酸性越强对应的盐水解能力越弱,等物质的量浓度的各溶液pH越小;B、正确,CN―离子要水解,现c(Na+)=c(CN-),HCN一定要过量,a一定大于b;C、不正确,质子守恒的式子为:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);D、不正确,

练习册系列答案
相关题目
 H2S+2OH-
H2S+2OH-
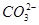 的物质的量浓度相同,则c1和c2的关系是
的物质的量浓度相同,则c1和c2的关系是