题目内容
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是


| A.KHC2O4溶液呈弱碱性 |
| B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-) |
| C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)< c(HC2O4-)+2c(C2O42-)+c(H2C2O4) |
| D.D点时:c(H+)+ c(HC2O4-)+ c(H2C2O4)= c(OH-) |
BC
试题分析:在曲线的B点处反应恰好生成KHC2O4,溶液为酸性,HC2O4-以电离为主,故有c(K+)>c(HC2O4-)>c(H+)>c(OH-),A错误B正确;在曲线的D点恰好反应生成K2C2O4,质子守恒式为c(H+)+ c(HC2O4-)+ 2c(H2C2O4)= c(OH-),故D错误;C点溶液为中性,K2C2O4含有少量KHC2O4,有c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+),电荷守恒为c(K+)=c(HC2O4-)+2c(C2O42-)( c(H+)= c(OH-)约去),故有c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4),所以C正确。

练习册系列答案
相关题目
 NH3·D2O + H+
NH3·D2O + H+ NH3.H2O
NH3.H2O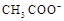 )+c(
)+c(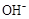 )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+) 将要变小
将要变小