题目内容
(9分)下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O

(1)请回答:
甲电池是 装置,B(石墨)电极的名称是 。
(2)写出下列电极反应式:
通入CH3OH 的电极的电极反应式是: ,
B(石墨)电极的电极反应式为: 。
(3)乙池中反应的化学方程式为 。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子 mol。
2CH3OH+3O2+4KOH

(1)请回答:
甲电池是 装置,B(石墨)电极的名称是 。
(2)写出下列电极反应式:
通入CH3OH 的电极的电极反应式是: ,
B(石墨)电极的电极反应式为: 。
(3)乙池中反应的化学方程式为 。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子 mol。
(1)原电池(1分) 阳极(1分)
(2)CH3OH — 6e-+ 8OH- ==6H2O +CO32- (2分) 4OH——4e—=O2↑+2H2O(2分)
(3)4AgNO3+2H2O 4Ag+O2↑+4HNO3(2分)
4Ag+O2↑+4HNO3(2分)
(4)0.05(1分)
(2)CH3OH — 6e-+ 8OH- ==6H2O +CO32- (2分) 4OH——4e—=O2↑+2H2O(2分)
(3)4AgNO3+2H2O
 4Ag+O2↑+4HNO3(2分)
4Ag+O2↑+4HNO3(2分)(4)0.05(1分)
略

练习册系列答案
相关题目
 2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )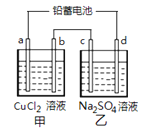

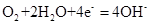

 该电池的负极反应式为 。
该电池的负极反应式为 。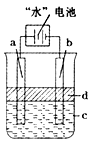
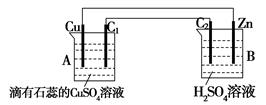
 、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。