题目内容
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1、+7 | -3、+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
请完成下列问题:
(1)W在周期表中的位置是___,X与P形成的化合物的电子式___。
(2)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(3)Z与Q两元素的最高价氧化物水化物之间发生反应的离子方程式为___。
(4)Y与R相比,非金属性较强的是___(用元素符号表示),根据下列方法能证明这一结论的是___(填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态
B.R、Y的氢化物稳定性不同
.Y与R形成的化合物中的化合价
D.R、Y的氧化物的水化物的酸性强弱
(5)用电子式表示由Z和R组成的化合物的形成过程___。
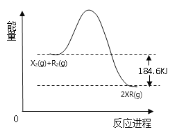
(6)如图为X2和R2燃烧反应的能量变化示意图,请根据此图写出该反应的热化学方程式为___(用物质化学式表示)。
【答案】第2周期VIA ![]() 同位素 OH-+Al(OH)3═AlO2-+2H2O Cl BC
同位素 OH-+Al(OH)3═AlO2-+2H2O Cl BC ![]() H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1
【解析】
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素。
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素;
(1)W为氧元素,核电荷数为8,其在周期表中的位置是第2周期第VIA族,H与N形成的化合物NH3是共价化合物,含3个N-H键,其电子式为![]() ;
;
(2)R为Cl元素,自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素;
(3)Z为Na元素,最高价氧化物水化物为NaOH;Q为Al元素,最高价氧化物水化物为Al(OH)3,两者之间发生反应的离子方程式为OH-+Al(OH)3═AlO2-+2H2O;
(4)Y为Si元素,R为Cl元素,为同周期主族元素,核电荷数大,非金属性强,即Cl元素非金属性比Si强;
A.单质的状态属于物理性质,不能说明元素的非金属性强弱,故A错误;
B.非金属越强,氢化物越稳定,稳定性HCl>SiH4,说明Cl的非金属性强,故B正确;
C.Y与R形成的化合物SiCl4中Si呈+4价,说明Cl吸引电子能力强,Cl的非金属性强,故C正确;
D.利用元素最高价氧化物的水化物的酸性强弱,可比较元素非金属性强弱,未指明是最高价氧化物,故D错误;
故答案为BC;
(5)Z为Na元素,R为Cl元素,两元素组成的化合物NaCl为离子化合物,其形成过程可表示为![]() ;
;
(6)1molH2在1molCl2中燃烧生成2molHCl气体,由能量变化示意图可知△H=-184.6kJ·mol-1,则反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案