题目内容
20.常温下,下列各组稀溶液中,加水稀释时c(OH-)/c(H+)的值明显减小,且能大量共存的离子组是( )| A. | K+、NH4+、HCO3-、AlO2- | B. | K+、Cl-、Fe3+、SO42- | ||
| C. | K+、I-、ClO-、Na+ | D. | Na+、SO32-、S2-、Cl- |
分析 A.离子能相互促进水解,而不能共存;
B.Fe3+水解,稀释促进水解,且该组离子之间不反应;
C.离子之间发生氧化还原反应;
D.SO32-、S2-均水解,稀释促进水解,且该组离子之间不反应.
解答 解:A.NH4+、AlO2-能相互促进水解,且AlO2-促进HCO3-的电离,不能大量共存,故A不选;
B.Fe3+水解,水解显酸性,稀释促进水解,c(OH-)/c(H+)值明显增大,且该组离子之间不反应,能共存,故B不选;
C.I-、ClO-发生氧化还原反应,不能大量共存,故C不选;
D.SO32-、S2-均水解,水解显碱性,稀释促进水解,c(OH-)/c(H+)值明显减小,且该组离子之间不反应,能共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重水解反应、氧化还原反应的离子共存考查,注意促进水解时生成离子的物质的量增大但浓度减小,题目难度不大.

练习册系列答案
相关题目
10.下列离子方程式书写正确的是( )
| A. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-=3I2+2H2O | |
| B. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| C. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2=2I2+2Fe3++6C1- | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
11.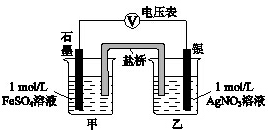 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
8.下列说法不正确的是( )
| A. | C2H4和C2H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3种二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
15.关于下列各装置图(略去部分夹持仪器)的叙述中,正确的是( )


| A. | 利用装置①进行盐酸待测溶液浓度的测定 | |
| B. | 利用装置②分离碘酒中碘和酒精 | |
| C. | 利用装置③制备收集干燥氨气 | |
| D. | 利用装置④加热分解碳酸氢钠 |
5. X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)R位于元素周期表第三周期第ⅥA族;T的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
(2)用“>”或“<”填空:
(3)在加热的条件下单质X可与R的浓的最高价氧化物的水化物反应,写出该反应的化学方程式并标出电子转移的方向和数目 (或
(或 ).
).
(4)Y及其同主族元素的氢化物沸点变化趋势如图所示,其中Y的氢化物沸点最高的原因是水分子间可以形成氢键,大大加强了分子间作用力,从而使水的沸点最高.
(5)在101KPa、25℃下,由最稳定单质生成1mol该化合物是的热效应称为该化合物的标准生成焓(△H).已知Z2O3标准生成焓(△H)为:△H=-399.09kJ/mol,T2O3的标准生成焓(△H)为:△H=-269.70kJ/mol,试写出单质Z和T2O3反应的热化学方程式2Al(s)+Cr2O3(s)=2Cr+Al2O3(s)△H=-129.39kJ/mol.
 X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| X | 元素最高正价与最低负价的绝对值相等 |
| Y | 是地壳中含量最多的元素 |
| Z | 元素基态原子3p能级只有一个电子 |
| W | 与Z位于同周期,能量最高的p 能级电子为半充满 |
| R | 单质为黄色固体,常存在于火山喷发口 |
| T | 元素基态原子核未成对电子最多 |
(1)R位于元素周期表第三周期第ⅥA族;T的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 离子还原性 | 最高价氧化物的熔点 |
| W>R | Y>Z | Y<R | X<Z |
 (或
(或 ).
).(4)Y及其同主族元素的氢化物沸点变化趋势如图所示,其中Y的氢化物沸点最高的原因是水分子间可以形成氢键,大大加强了分子间作用力,从而使水的沸点最高.
(5)在101KPa、25℃下,由最稳定单质生成1mol该化合物是的热效应称为该化合物的标准生成焓(△H).已知Z2O3标准生成焓(△H)为:△H=-399.09kJ/mol,T2O3的标准生成焓(△H)为:△H=-269.70kJ/mol,试写出单质Z和T2O3反应的热化学方程式2Al(s)+Cr2O3(s)=2Cr+Al2O3(s)△H=-129.39kJ/mol.
12. 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
下列有关说法不正确的是( )
 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法不正确的是( )
| A. | 工业上制备水泥的原料有黏土、石灰石、石膏 | |
| B. | 测量原理装置图中Ag2O/Ag极发生还原反应 | |
| C. | 负极的电极反应式为2Cu+H2O-2e-=Cu2O+2H+ | |
| D. | 在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化 |

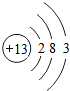 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”). .
.