题目内容
如图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体.
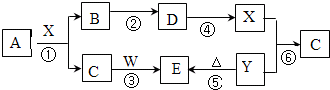
据此回答下列问题:
(1)物质W中所含有的化学键类型为
(2)物质C的结构式为
(3)如图反应中不属于氧化还原反应的有
(4)写出A和X反应的化学方程式
(5)请写出C和W反应的化学方程式:
(6)请写出X和 Y反应的离子方程式:

据此回答下列问题:
(1)物质W中所含有的化学键类型为
离子键和共价键
离子键和共价键
,其阴、阳离子个数比为1:2
1:2
.(2)物质C的结构式为
O=C=O
O=C=O
.(3)如图反应中不属于氧化还原反应的有
④⑤⑥
④⑤⑥
(填写序号).(4)写出A和X反应的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为
| ||
1.204×1024
1.204×1024
.(5)请写出C和W反应的化学方程式:
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
.(6)请写出X和 Y反应的离子方程式:
H++HCO3-=CO2↑+H2O
H++HCO3-=CO2↑+H2O
.分析:常温下B和C呈气态,且B是导致酸雨的大气污染物,则B是SO2,W是淡黄色固体,能和气体C反应,则W是Na2O2,C可能是二氧化碳或水,二氧化碳和过氧化钠反应生成Na2CO3,水和过氧化钠反应生成氢氧化钠和氧气,Y分解生成E,则E是Na2CO3,Y是NaHCO3,C是CO2,X和碳酸氢钠反应生成二氧化碳,说明X是酸,D反应生成酸,二氧化硫反应生成D,A和酸反应生成二氧化碳、二氧化硫,A是单质,则A是C,根据元素守恒知,X是H2SO4,D是SO3,结合物质的性质以及题目要求解答该题.
解答:解:常温下B和C呈气态,且B是导致酸雨的大气污染物,则B是SO2,W是淡黄色固体,能和气体C反应,则W是Na2O2,C可能是二氧化碳或水,二氧化碳和过氧化钠反应生成Na2CO3,水和过氧化钠反应生成氢氧化钠和氧气,Y分解生成E,则E是Na2CO3,Y是NaHCO3,C是CO2,X和碳酸氢钠反应生成二氧化碳,说明X是酸,D反应生成酸,二氧化硫反应生成D,A和酸反应生成二氧化碳、二氧化硫,A是单质,则A是C,根据元素守恒知,X是H2SO4,D是SO3,
(1)W是Na2O2,含有离子键和共价键,阴、阳离子个数比为1:2,故答案为:离子键和共价键;1:2;
(2)C是CO2,为直线形分子,结构式为O=C=O,故答案为:O=C=O;
(3)上述反应中,不属于氧化还原反应的是④⑤⑥,元素的化合价没有放出变化,故答案为:④⑤⑥;
(4)在加热条件下,碳和浓硫酸发生氧化还原反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
n(SO2)=1mol,转移电子2mol,电子数为1.204×1024,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;1.204×1024;
(5)二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(6)X是硫酸,Y是碳酸氢钠,硫酸和碳酸氢钠反应生成硫酸钠、二氧化碳和水,离子反应方程式为:H++HCO3-=CO2↑+H2O,
故答案为:H++HCO3-=CO2↑+H2O.
(1)W是Na2O2,含有离子键和共价键,阴、阳离子个数比为1:2,故答案为:离子键和共价键;1:2;
(2)C是CO2,为直线形分子,结构式为O=C=O,故答案为:O=C=O;
(3)上述反应中,不属于氧化还原反应的是④⑤⑥,元素的化合价没有放出变化,故答案为:④⑤⑥;
(4)在加热条件下,碳和浓硫酸发生氧化还原反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)
| ||
n(SO2)=1mol,转移电子2mol,电子数为1.204×1024,
故答案为:C+2H2SO4(浓)
| ||
(5)二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(6)X是硫酸,Y是碳酸氢钠,硫酸和碳酸氢钠反应生成硫酸钠、二氧化碳和水,离子反应方程式为:H++HCO3-=CO2↑+H2O,
故答案为:H++HCO3-=CO2↑+H2O.
点评:本题考查了无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,以“淡黄色固体、B是形成酸雨的成分”为突破口采用正逆相结合的方法进行推断,明确物质的性质是解本题关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 乙酸乙酯的实验室和工业制法常采用如下反应:
乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
| ||
| △ |
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;
②部分有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)浓硫酸的作用是
(2)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为
(3)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
| 同一反应时间 | 同一反应应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 | |||||
a.120℃,4hb.80℃,2hc.60℃,4hd.40℃,3h
②当反应温度达到120℃时,反应选抒性降低的原因可能为
近年来,我国部分地区多次陷入严重雾霾之中,其中一个重要的原因是我国的能源消费结构以燃煤为主,改变煤的利用方式可减少环境污染.以下是对煤进行处理的方法:
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在 下能自发进行(填“高温”或“低温”);
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 .(已知:H2S Ka1=9.1×10-8;Ka2=1.1×10-12 H2CO3 Ka1=4.30×10-7;Ka2=5.61×10-11)
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
①一步法合成二甲醚:3H2(g)+3CO(g)=CH3OCH3(g)+CO2 (g)△H= .
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是 (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:
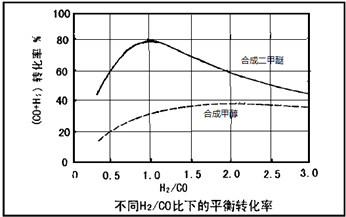
①合成二甲醚的最佳H2/CO比为 .对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),写出“一步法”合成二甲醚的KP= ,提高H2/CO比,则KP (填“变大”、“变小”或“不变”)
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率 .
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:

①合成二甲醚的最佳H2/CO比为
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率
 硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示). 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得: