题目内容
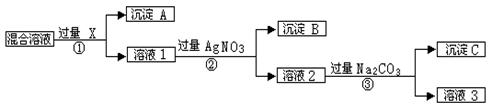
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
解析:略

(12分,每空2分)
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899 |
1 757 |
14 840 |
21 000 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
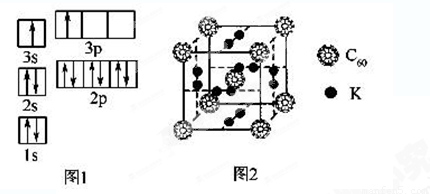
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
 ________________
________________ 请回答下列问题:
请回答下列问题:
 Fe3+。在过程A中,Fe2+作
剂,过程B中,Fe3+作
剂。
Fe3+。在过程A中,Fe2+作
剂,过程B中,Fe3+作
剂。