��Ŀ����
����Ŀ�������ܿ�����ָʾ���ʹ������Ʊ�����ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2�ȣ���ȡCoC2O4��2H2O�����������£�
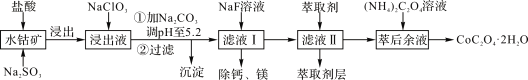
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�����������£�ClO3-��������Co2+��ClO3-ת��ΪCl-��
�۲���������������������ʽ����ʱ��Һ��pH������
������ | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
��ȫ������pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
��1�����������м���Na2SO3����ҪĿ����________��
��2�������Һ�м���NaClO3�����ӷ�Ӧ����ʽ��_________��
��3����֪��������NH3��H2O![]() NH4+��OH- Kb��1.8��10-5
NH4+��OH- Kb��1.8��10-5
H2C2O4![]() H+��HC2O4- Ka1��5.4��10-2
H+��HC2O4- Ka1��5.4��10-2
HC2O4-![]() H��C2O42- Ka2��5.4��10-5
H��C2O42- Ka2��5.4��10-5
�������������(NH4)2C2O4��Һ��pH______7�������������=������
��4������(NH4)2C2O4 ��Һ���������壬�ٹ��ˡ�ϴ�ӣ�ϴ��ʱ��ѡ�õ��Լ��У�________��
A������ˮ B������ˮ C�����͵�(NH4)2C2O4��Һ D��ϡ����
��5����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ1����ȡ����������________����ʹ�õ�����pH��Χ��________��
A��2.0��2.5 B��3.0��3.5 C��4.0��4.5
��6��CoC2O4��2H2O�ȷֽ������仯������ͼ2��ʾ������600����ǰ�Ǹ����������ȣ�600 ���Ժ����ڿ����м��ȡ�A��B��C��Ϊ�����C����ʾ����Ļ�ѧʽ��________��

���𰸡� ��Co3+��Fe3+��ԭΪCo2+��Fe2+��ֻҪ�ش�Co3+��ԭΪCo2+�����֣����� ClO3-��6Fe2+ + 6H+= Cl-��6Fe3+ + 3H2O �� A ��ȥ��Һ�е�Mn2+ B Co2O3
��������(1)�������ƾ��л�ԭ�ԣ��ܻ�ԭ����������Fe3+��Co3+�����Խ��������м���Na2SO3��Ŀ���ǽ�Fe3+��Co3+��ԭ����ԭΪFe2+��Co2+��
(2)NaClO3���������ԣ��ܽ�����Һ�е�Fe2+������Fe3+����������ԭ���������ӣ�ͬʱ����ˮ�����ӷ�Ӧ����ʽΪClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O��
(3)����ˮ�⣬˭ǿ��˭�ԣ�NH3H2ONH4++OH- Kb=1.8��10-5��HCO4-H++C2O42- Ka2=5.4��10-5������(NH4)2C2O4��Һ��笠�����ˮ����ڲ��������ˮ�⣬��Һ�����ԣ���PH��7��
(4)Ϊ��ȥ(NH4)2C2O4 �������ĸ���Һ��ϴ��ʱ��ѡ������ˮϴ�ӣ������ɵõ��������ľ��壬�ʴ�ΪA��
(5)��������ͼ��֪����ʱ��Һ�д���Mn2+��Co2+�������ӣ�����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��֪��������ҺPH��3.0��3.5֮�䣬��ΪB����ʹMn2+��ȫ����������ֹCo2+ת��ΪCo(OH)2������
(6)��ͼ��֪��C��������������Ϊ8.03g��0.1molCoԪ������Ϊ5.9g������������Ԫ������Ϊ8.03g-5.9g=2.13g������������Coԭ����Oԭ�����ʵ���֮��Ϊ0.1mol�� ![]() ��2:3����C��Co������ΪCo2O3��
��2:3����C��Co������ΪCo2O3��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�