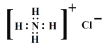题目内容
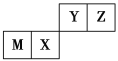
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。则下列说法不正确的是
A. M形成的简单离子的半径小于Z的形成的简单离子的半径
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期第ⅥA族
【答案】B
【解析】
由元素位置可知Y、Z在第二周期,M、X在第三周期,由于只有M为金属,故Y、Z、M、X四种元素分别为N、O、Al、Si 。
A. M形成的简单离子为Al3+,Z形成的简单离子为O2-,二者电子层结构相同,电子层结构相同,核电荷数越大半径越小,M形成的简单离子的半径小于Z的形成的简单离子的半径,故A正确;
B..非金属性:N> Si,则HNO3酸性比H2SiO3强,故B错误;
C.非金属性:Si<O,则热稳定性SiH4比H2O弱,故C正确;
D.O元素位于周期表中第二周期、第VIA族,故D正确。答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
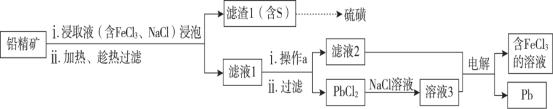
已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是___________________________________________________________________。
③将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
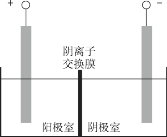
ⅰ.溶液3应置于_________ (填“阴极室”或“阳极室”)中。
ⅱ.简述滤液2电解后再生为FeCl3的原理______________________________________。
ⅲ.若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___________。