题目内容
4.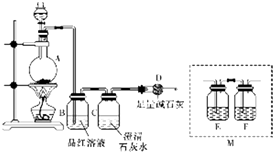 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.(1)装置B的作用是检验SO2的存在.
(2)甲同学观察到装置C中有白色沉淀生成.他得出了使澄清石灰水变浑浊的气体是二氧化碳的结论.装置A中能产生二氧化碳的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B~C之间添加装置M,装置E、F中盛放的试剂分别是酸性KMnO4溶液或溴水(或其他合理答案)、品红溶液.重新实验后观察到装置F中的现象是品红溶液不褪色或无明显现象.
(4 )有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂铜粉使溶液中的Fe3+完全转化为Fe2+过滤,得到滤液B;
Ⅱ.将滤液B稀释为250mL;
Ⅲ.取稀释液25.00mL,用浓度为c mol•L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL.
①步骤Ⅱ中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是250mL容量瓶.
②滴定过程中不需要(填“需要”或“不需要“)加入指示剂.
③铁碳合金中铁元素的质最分数为$\frac{2.8cV}{m}$×100%.
分析 (1)二氧化硫具有漂白性,能使品红溶液褪色;
(2)加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2和H2O,根据反应物、生成物和反应条件书写方程式;
(3)SO2也能使澄清石灰水变浑浊,用澄清石灰水检验CO2之前要除去SO2,防止对CO2造成干扰;
(4)①配制一定物质的量浓度的溶液还需要容量瓶;
②Fe2+和高锰酸钾发生氧化还原反应而使溶液褪色,高锰酸钾溶液有颜色、生成的锰离子无色,所以有明显的颜色变化,不需要指示剂;
③根据5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O中5Fe2+~MnO4-计算亚铁离子的物质的量,再根据Fe原子守恒计算Fe的质量,质量分数=$\frac{铁的质量}{铁、碳的质量}$×100%.
解答 解:(1)SO2能和有色物质反应生成无色物质而具有漂白性,SO2能使品红溶液褪色,所以B可以检验SO2的存在,
故答案为:检验SO2的存在;
(2)加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2和H2O,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)SO2也能使澄清石灰水变浑浊,用澄清石灰水检验CO2之前要除去SO2,防止对CO2造成干扰,所以在B-C之间增加装置酸性高锰酸钾溶液或溴水和品红溶液,酸性高锰酸钾或溴水是吸收二氧化硫、品红溶液是检验二氧化硫是否除尽,如果二氧化硫完全被吸收,则F中溶液不褪色或无明显现象,
故答案为:酸性KMnO4溶液或溴水(或其他合理答案);品红溶液;品红溶液不褪色或无明显现象;
(4)①配制250mL的溶液还需要规格为250mL的容量瓶,故答案为:250mL容量瓶;
②Fe2+和高锰酸钾发生氧化还原反应而使溶液褪色,高锰酸钾溶液有颜色、生成的锰离子无色,所以有明显的颜色变化,所以不需要未加指示剂,
故答案为:不需要;
③设参加反应的亚铁离子的物质的量为x,
根据5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O可得关系式:5Fe2+~MnO4-,
5Fe2+~MnO4-
5mol 1mol
x 0.001cVmol
5mol:1mol=x:0.001cVmol
解得:x=$\frac{5mol×0.001cVmol}{1mol}$=0.005cVmol,
则250mL滤液中n(Fe2+)=0.005cVmol×10=0.05cVmol,
根据Fe原子守恒得n(Fe)=(Fe2+)=0.05cVmol,
m(Fe)=0.05cVmol×56g/mol=2.8cVg
Fe质量分数为:$\frac{2.8cVg}{mg}$×100%=$\frac{2.8cV}{m}$×100%,
故答案为:$\frac{2.8cV}{m}$×100%.
点评 本题以浓硫酸和Fe、C反应为载体考查性质实验方案设计,还涉及氧化还原反应、物质含量的测定、仪器的选择、实验基本操作等知识点,题目难度中等,试题综合性较强,注意熟悉流程中各个装置发生的反应、实验目的,明确二氧化硫和二氧化碳检验顺序,为易错点.

 口算题天天练系列答案
口算题天天练系列答案①微粒半径:S2->Cl->Na+>Al3+ ②氢化物的稳定性:HF>HCl>H2S>H2Se
③氧化性:Cl2>S>Se>Te ④酸性:H2SO4>HClO4>H2SeO4
⑤得电子能力:F>Cl>Br>I ⑥还原性:F->Cl->Br-.
| A. | 只有① | B. | ①②④⑥ | C. | ①②③⑤ | D. | 只有⑤ |
| A. | 碳酸钠 | B. | 氢氧化镁 | C. | 过氧化钠 | D. | 氧化铝 |

回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
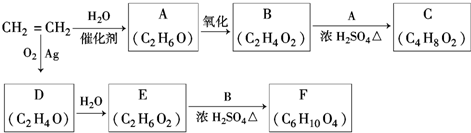
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应; ;
; 利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.
利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.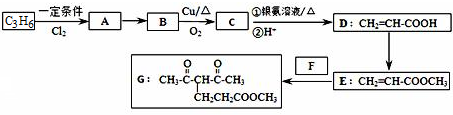

 或
或
 Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题:
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题: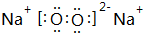 ;
;