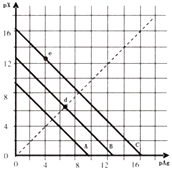
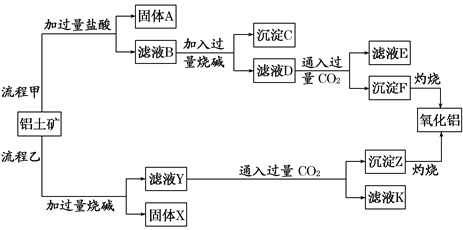
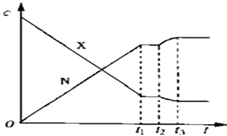
题目内容
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4 , B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液. 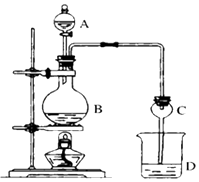
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH.
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O℃在CH3CH2OH中),写出能表示18O位置的化学方程式 .
(2)球形干燥管C的作用是 . 若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示):;反应结束后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在左右.
【答案】
(1)催化剂、吸水剂;CH3COOH+CH3CH218OH ![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
(2)防止倒吸、冷凝;CO32﹣+H2O?HCO3﹣+OH﹣;溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)乙醇(或CaCl2?6C2H5OH);77.1℃
【解析】解:(1)浓硫酸能与醋酸钠反应生成乙酸,乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;乙酸酸与乙醇发生的酯化反应:CH3COOH+CH3CH218OH ![]() CH3CO18OC2H5+H2O,所以答案是:催化剂、吸水剂;CH3COOH+CH3CH218OH
CH3CO18OC2H5+H2O,所以答案是:催化剂、吸水剂;CH3COOH+CH3CH218OH ![]() CH3CO18OC2H5+H2O;(2)球形干燥管的管口伸入液面下可以防止倒吸,同时起冷凝的作用;碳酸根离子发生水解CO32﹣+H2OHCO3﹣+OH﹣ , 溶液呈碱性,加入几滴酚酞,溶液呈红色;碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,溶液分层,上层无色油体液体,乙酸和碳酸钠反应,碱性减弱而使溶液红色变浅,
CH3CO18OC2H5+H2O;(2)球形干燥管的管口伸入液面下可以防止倒吸,同时起冷凝的作用;碳酸根离子发生水解CO32﹣+H2OHCO3﹣+OH﹣ , 溶液呈碱性,加入几滴酚酞,溶液呈红色;碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,溶液分层,上层无色油体液体,乙酸和碳酸钠反应,碱性减弱而使溶液红色变浅,
所以答案是:防止倒吸、冷凝;CO32﹣+H2OHCO3﹣+OH﹣;溶液分层,上层无色油体液体,下层溶液颜色变浅;(3)用氯化钙除去少量乙醇,过滤分离出乙醇(或CaCl26C2H5OH),用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;乙酸乙酯的沸点为77℃,所以收集77℃左右的馏分,以得较纯净的乙酸乙酯,
所以答案是:乙醇(或CaCl26C2H5OH);77.1℃.

【题目】目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应.应用如图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 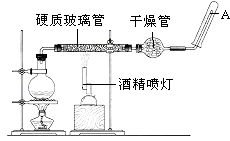
请回答下列的问题.
(1)铁在周期表中的位置是 .
(2)请写出该反应的化学方程式: .
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为 .
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含b mol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO.试回答下列问题: ①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① | ② | ③ | ④ | |
溶液中的金属离子 | Fe2+ | |||
残留固体成分 | Fe、Pt | Pt | Pt |
②当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mL NO.则a= , b= .