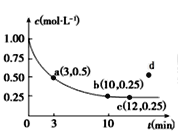
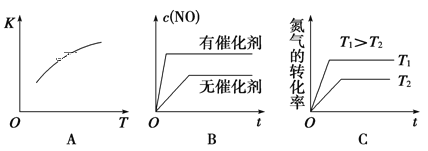
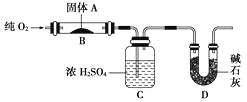
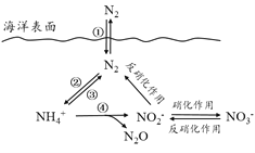
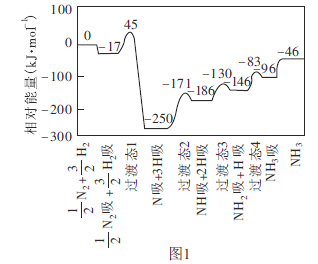
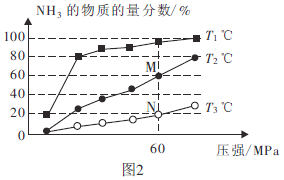
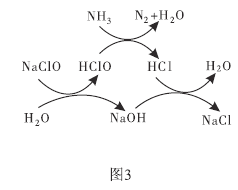
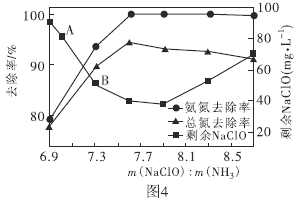
题目内容
【题目】在100ml pH=1的硫酸溶液中,加入多少毫升0.01mol·L-1的NaOH溶液,才能使混合液的pH=2?(假设溶液体积不变)______________ mL
【答案】450mL
【解析】
混合后溶液pH=2,说明酸过量,根据H++OH-=H2O,可知OH-的物质的量等于反应消耗的H+的物质的量,然后利用c= 计算反应后溶液中c(H+),最后结合根据pH= -lg c(H+)=2计算。
计算反应后溶液中c(H+),最后结合根据pH= -lg c(H+)=2计算。
向pH=1的硫酸溶液中加入NaOH,发生反应:H++OH-=H2O,反应后溶液的pH=2,溶液显酸性,说明酸过量,由于在酸、碱混合时溶液体积不变,则根据pH= -lgc(H+)=2,c(H+)=0.01mol/L,可得![]() =0.01mol/L,解得V=0.45L=450mL。
=0.01mol/L,解得V=0.45L=450mL。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
【题目】中国医药学是一个伟大的宝库。古代制取下列药物过程中未发生氧化还原反应的是( )
A | 《本草纲目》:制取“玄明粉”( | 以芒硝于风日中消尽水气,自成轻飘白粉也 |
B | 《通玄秘术》:制取“华盖丹”(醋酸铅) | 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口…… |
C | 《本草蒙筌》:制取“灵砂”(硫化汞) | 水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… |
D | 《本草图经》:制取“铁华粉”(醋酸亚铁) | 以铁拍做段片,置醋糟中,积久衣生…… |
A.AB.BC.CD.D